Определение коррозии
Материалы из металлов под химическим или электрохимическим воздействием окружающей среды подвергаются разрушению, которое называется коррозией.
Коррозия металлов вызывается окислительно-восстановительными реакциями, в результате которых металлы переходят в окисленную форму и теряют свои свойства, что приводит в негодность металлические материалы.
Можно выделить 3 признака, характеризующих коррозию:
- Коррозия – это с химической точки зрения процесс окислительно-восстановительный.
- Коррозия – это самопроизвольный процесс, возникающий по причине неустойчивости термодинамической системы металл – компоненты окружающей среды.
- Коррозия – это процесс, который развивается в основном на поверхности металла. Однако, не исключено, что коррозия может проникнуть и вглубь металла.
Почему металл корродирует?
Жизнь современного человека нельзя представить без металлов. Они окружают нас везде — это и бытовая техника в наших домах, и транспортные средства, на которых мы добираемся до дома или работы, и смартфоны, без которых многие из нас не представляют жизнь. Почти всё, что нас окружает состоит из металлов, но, к сожалению, как и всё в этом мире, они не вечны и под действием внешней среды разрушаются — корродируют.
Почему коррозия «выгодна» для металлов? Дело в том, что большинство из них существуют в природе в химически связанном состоянии, например, в виде оксидов (корунд) или сульфидов (пирит). В чистом виде почти все металлы неустойчивы и чтобы выделить их из соединений приходится затрачивать немалую энергию. Обратный же процесс, когда металлы переходят в связанное состояние, всегда термодинамически более выгоден. Поэтому он происходит самопроизвольно, а металлы при любой возможности стремятся вступить в реакцию со своим окружением и перейти в более устойчивую форму. Иллюстрация этого представлена на рисунке 1.
Рисунок 1 – Схема восстановления металла из руд с последующей коррозией (окислением). Э – условный уровень энергии. Коррозия приводит к огромным экономическим затратам, а её следствием становятся глобальные экологические катастрофы. Потеря металлофонда от коррозии составляет порядка 12% в год.
Помимо прямых потерь существуют и косвенные потери, вызываемые коррозией:
- из-за простоя оборудования вызванных авариями;
- из-за снижения мощностей оборудования;
- из-за снижения качества продукции;
- на ликвидацию последствий аварии;
- на ремонт оборудования;
- на дальнейшую защиту от коррозии.
Виды коррозии металлов
Наиболее часто встречаются следующие виды коррозии металлов:
- Равномерная – охватывает всю поверхность равномерно
- Неравномерная
- Избирательная
- Местная пятнами – корродируют отдельные участки поверхности
- Язвенная (или питтинг)
- Точечная
- Межкристаллитная – распространяется вдоль границ кристалла металла
- Растрескивающая
- Подповерхностная
Основные виды коррозии металлов
С точки зрения механизма коррозионного процесса можно выделить два основных типа коррозии: химическую и электрохимическую.
Заказывайте оцинковку металла в Точинвест Цинк
Каждый клиент при обращении в нашу компанию получает следующие преимущества:
- Компания работает с 2007 года, имеет в своем распоряжении 3 производственных цеха для горячего цинкования.
- Мощность предприятия с многолетним опытом составляет 120 000 тонн в год.
- Оперативное проведение работ, независимо от сложности и объема.
- Наше предприятие является обладателем самой глубокой ванны для горячего цинкования в ЦФО – глубина составляет 3.43 м.
- Наносим цинковое покрытие на различные виды металлоконструкций, включая габаритные.
- Нанесение покрытия по технологии горячего цинкования специалисты выполняют в соответствие с требованиями ГОСТ 307-89.
Работы проводятся на современном оборудовании чешской компании EKOMOR и немецко-австрийской компании KVK KOERNER.
Вернуться к статьям Поделиться статьей
Электрохимическая коррозия металлов
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
- Анодного – металл в виде ионов переходит в раствор.
- Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель).
Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
Водородная деполяризация
Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде:
2H++2e— = H2 разряд водородных ионов
2H3O++2e— = H2 + 2H2O
Кислородная деполяризация
Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде:
O2 + 4H++4e— = H2O восстановление растворенного кислорода
O2 + 2H2O + 4e— = 4OH—
Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов:
- Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители.
- Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах.
- Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители.
- Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей.
Виды электрохимической коррозии
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
- Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
А: Fe – 2e— = Fe2+
K: O2 + 4H+ + 4e— = 2H2O
Катодом является та поверхность, где больше приток кислорода.
- Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
- Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
- Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
- Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла.
- Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Классификация коррозионных процессов по характеру коррозионного разрушения.
4.1 Контактная коррозия.
Контактная коррозия образуется при контакте разных металлов в присутствии электролита или влажного воздуха. В образовавшейся гальванопаре, металл с более электроотрицательным потенциалом становится анодом и разрушается в первую очередь, тогда как более электроположительный металл – катодом.
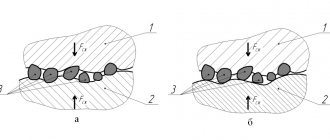
В качестве примера можно рассмотреть железо (рисунок 4). Цинк, алюминий и кадмий (последний — в солевой среде) являются анодами для стали, а значит именно они будут окисляться в первую очередь, тогда как олово, хром, медь, свинец, никель – катодами, а значит железо будет подвержено глубокой локальной коррозии, пример изображён на рисунке.
Рисунок 4 – Примеры контактной коррозии на стали.
4.2 Щелевая коррозия.
Щелевая коррозия
– это коррозия, возникающая в случаи, если часть металла изолирована от основного участка неметаллическим материалом (резиной, деревом, пластиком и т.д.). Пример такой коррозии можно наблюдать в трубах в месте соприкосновения с сальником (рисунок 5). Образование полости под сальником вызывает протечки в трубах. При наличии таких неровностей коррозионная жидкость застаивается в щели, где и происходит бурная коррозия металла.
Причиной щелевой коррозии является пониженная концентрация окислителей в зазорах по сравнению с объёмом раствора и замедленный отвод продуктов коррозии. В результате их накопления меняется pH раствора в щели, что так же ускоряет коррозию.
Металл в щели и металл открытой поверхности образуют макропару:
Me — 2е = Me2+ (внутри щели) 0,5О2 + H2O + 2е = 2ОН- (на поверхности металла)
Поскольку площадь открытой поверхности гораздо больше, чем внутри щели, плотность тока коррозии внутри щели оказывается чрезвычайно высокой.
Рисунок 5 – Кислородная концентрационная ячейка под сальником. По мере протекания коррозии внутри щели накапливается избыточный положительный заряд. Ионы ОН- устремляются в щель, чтобы нейтрализовать этот заряд. В результате, на внутренней поверхности щели осаждается гидроксид металла, что ещё больше сокращает эффективную площадь анода.
4.3 Питтинговая коррозия.
Питтингом
называют глубокие поражения (точечные язвы) на поверхности металла (рисунок 6). Питтинговая коррозия, вследствие своей локализованности и малой заметности, является одним из наиболее опасных видов коррозионного разрушения. Не следует путать питтиговую коррозию с питтингом на никелевых покрытиях.
Так как пассирующий слой на поверхности металла не является гомогенной системой, то коррозия возникает из-за наличия анодных и катодных участков на поверхности. В возникшей гальванопаре анодом является питтинг, а катодом – остальная часть поверхности. На аноде происходит высвобождение электронов, которые восстанавливают кислород на катодной пассивированной части поверхности.
Рисунок 6 – Виды питтингов: а – открытый с защитным слоем на окружающей поверхности; б – закрытый, без окружающего защитного слоя; в – закрытый, с окружающим защитным слоем. 1 – металл; 2 – раствор; 3 – защитный слой; 4 – пористые продукты коррозии; 5 – крышка над питтингом; 6 – отверстия в крышке. Развитию питтинга способствуют различного рода дефекты на поверхности пассивной плёнки, например, царапины, сколы, поры, посторонние включения. Также для возникновения питтинга необходимо, чтобы в растворе одновременно находились активаторы питтинговой коррозии (Cl-, Br-, J-, CN-) и пассиваторы металла (OH-, SO42-, NO3-,ClO4-).
4.4 Межкристаллитная коррозия.
Межкристаллическая коррозия
возникает из-за разницы потенциалов на границе зерна и в его матрице (рисунок 7).
На воздухе на границе зерна образуется карбидная фаза, что сдвигает потенциал в область более электроотрицательных значений. Таким образом граница зерна является анодом по отношению к их матрице.
Наиболее опасен данный тип коррозии для сплавов, так как в месте скопления более электроотрицательного металла будет образовываться анод, а основного – катод. Например, для нержавеющих сталей, содержащих хром, вблизи границ зёрен содержание хрома оказывается ниже, чем на остальной поверхности, что делает их менее пассивированными. Вследствие этого такие места становятся анодами по отношению к матрице зерна.
Рисунок 7 – Межкристаллическая коррозия нержавеющей стали: 1 – катод; 2 – анод; 3 – карбидная фаза; 4 – зона, обеднённая хромом; 5 – граница зёрен.
4.5 Фреттинг-коррозия.
Фретинг-коррозия
происходит между двумя поверхностями, находящимися в непрерывном контакте друг с другом и совершающими малые колебания. Поверхности никогда не отрываются друг от друга, поэтому в точках механического контакта происходит накопление осколков продуктов коррозии.
Данная коррозия возникает при незначительных колебаниях, циклических или возвратно-поступательных движений с малыми амплитудами и скоростями. Этой коррозии подвергаются болты, заклёпки, шарниры, муфты, клапаны, детали двигателей и пр.
4.6 Коррозионное растрескивание под напряжением.
Коррозионное растрескивание под напряжением возникает, когда металлическое изделие подвержено растяжению в коррозионной среде. Тогда даже при напряжениях ниже напряжения разрушения происходит растрескивание, в конце концов, приводящее к разрушению конструкции или изделия.
На растянутых участках металла идёт коррозия, поскольку они оказываются анодами по отношению к нерастянутой части. Это явление наблюдается на любых металлах и сплавах, а также в любых средах.
4.7 Коррозионная усталость.
Коррозионная усталость возникает вследствие одновременного воздействия агрессивной среды и механической нагрузки.
Коррозионная усталость часто бывает причиной «неожиданного» разрушения металлических деталей, так, если деталь, находящаяся в коррозионном окружении, подвержена непрерывным вибрациям, её разрушение происходит при напряжении гораздо ниже предела выносливости.
Методы защиты от коррозии металла
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях. Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Неметаллические покрытия
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия
В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.);
фосфатирование – получение защитной пленки фосфатов (Fe3(PO4)2, Mn3(PO4)2);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с органическими веществами;
цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла и коррозионной среды
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
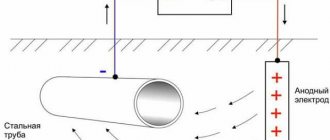
Электрохимическая защита
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Примеры задач с решениями на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов, а также уравнения реакций, протекающих при электрохимической коррозии металлов приведены в разделе Задачи к разделу Коррозия металлов
Категории Коррозия металлов, ОБЩАЯ ХИМИЯ
Химическая
Химическая коррозия относится к постепенному разрушению поверхности металла из-за реакции поверхности с веществами во внешней среде. Она происходит в результате окисления металла кислотами с образованием оксидов.
Высокотемпературный вариант заключается в воздействии на металл сухих газов. Все металлы в сухом воздухе покрыты очень тонким (2…10 мкм) слоем оксидов. Этот слой образуется при очень высоких температурах, когда реакция с кислородом воздуха идёт без каких-либо ограничений. При комнатной температуре реакция останавливается, поскольку оксидная плёнка становится слишком тонкой. В случае, например, с алюминием, такая плёнка, состоящая из оксида Al2O3,эффективно защищает поверхность алюминиевой посуды, поскольку коррозионная стойкость чистого алюминия невысока.
Химическая коррозия начинается в месте, где металл находится под давлением и изолирован от циркуляции воздуха. Это побуждает ионы металлов растворяться во влажной среде, что в конечном итоге ускоряет реакцию между ними и водой. В результате реакции образуются водные оксиды (известные при взаимодействии с железом как ржавчина) и свободные ионы.
Химическая коррозия в жидкостях-неэлектролитах
Хотя газовая коррозия считается наиболее распространенной, порчу металла при контакте с различными жидкостями-электролитами также не стоит сбрасывать со счетов. Большую опасность представляет контакт материала с веществами, способными проводить электричество.
Их делят на две крупные группы – органические и неорганические. Электролитов, представляющих большую опасность для металла, много – от расплавленной серы и бензола до жидкого брома, спирта, керосина, нефти и других.
Большое значение при протекании химической реакции играет чистота электролита. Когда он полностью чист, взаимодействия не наблюдается. Но стоит только попасть в состав небольшому количеству примесей, реакция начинает развиваться особенно стремительно.
Еще один дополнительный фактор риска – присутствие влаги. Тогда к опасности химической коррозии также прибавляется и угроза электрохимической.
Стадии протекания коррозии в жидкостях-неэлектролитах
Если рассматривать весь процесс более подробно и анализировать, что влияет на скорость химической коррозии, можно выделить несколько стадий ее протекания:
- Контакт окислителя с поверхностью материала.
- Запуск процесса хемосорбции реагента на поверхности.
- Протекание реакции металла и окислителя, формирование оксидной пленки.
Условия среды, состав сплава и самого электролита могут повлиять на протекание нескольких основных процессов. К ним относятся такие, как десорбция оксидов с металлом и диффузия оксидов в неэлектролит. Но оба процесса также могут и не наблюдаться.
Чтобы не допустить запуска коррозии в жидкостях-электролитах, стоит позаботиться о нанесении на поверхность специальных защитных составов. Важно, чтобы на протяжении всего времени использования изделия они полностью сохраняли свою целостность.
Виды оксидных пленок
Когда химическая коррозия происходит под действием температуры и газовой среды, могут сформироваться три вида пленок:
- Тонкие. Со стороны заметить их будет невозможно. Они одни из самых не прочных, могут легко стираться под действием механического давления.
- Средние. Могут быть замечены, потому что со стороны металл слегка меняет цвет.
- Толстые. Хорошо заметны невооруженным глазом.
Чтобы не допустить протекание опасных процессов разрушения материала, важно сделать пленку защитной.