Определение коррозии
Материалы из металлов под химическим или электрохимическим воздействием окружающей среды подвергаются разрушению, которое называется коррозией.
Коррозия металлов вызывается окислительно-восстановительными реакциями, в результате которых металлы переходят в окисленную форму и теряют свои свойства, что приводит в негодность металлические материалы.
Можно выделить 3 признака, характеризующих коррозию:
- Коррозия – это с химической точки зрения процесс окислительно-восстановительный.
- Коррозия – это самопроизвольный процесс, возникающий по причине неустойчивости термодинамической системы металл – компоненты окружающей среды.
- Коррозия – это процесс, который развивается в основном на поверхности металла. Однако, не исключено, что коррозия может проникнуть и вглубь металла.
Факторы скорости протекания газовой химической коррозии
По мере исследования особенностей процесса протекания химической коррозии, ученые смогли определить важные факторы, которые влияют на ее скорость и другие особенности. К ним относятся такие, как:
- Температура среды, в которую погружен металл.
- Состав сплава и другие особенности металла.
- Особенности газовой среды, ее состав, преобладающие элементы.
- Длительность контактирования материала с коррозийной средой.
- Появляющийся продукт коррозии.
Как и в случае с другими типами коррозийных поражений, большое значение имеет тип и особенности создающейся на поверхности оксидной пленки.
Виды коррозии металлов
Наиболее часто встречаются следующие виды коррозии металлов:
- Равномерная – охватывает всю поверхность равномерно
- Неравномерная
- Избирательная
- Местная пятнами – корродируют отдельные участки поверхности
- Язвенная (или питтинг)
- Точечная
- Межкристаллитная – распространяется вдоль границ кристалла металла
- Растрескивающая
- Подповерхностная
Основные виды коррозии металлов
С точки зрения механизма коррозионного процесса можно выделить два основных типа коррозии: химическую и электрохимическую.
Какой из видов коррозионного разрушения наиболее опасен?
Невозможно дать однозначный ответ. Все зависит от условий эксплуатации изделий. Например, для силовых элементов конструкций наиболее опасны межкристаллитная коррозия и коррозионное растрескивание.
Для резервуаров, трубопроводов наиболее опасна точечная либо язвенная коррозия.
Для поверхностей трения, электрических контактов, высокочастотных волноводов наиболее опасна сплошная коррозия.
В некоторых случаях опасна не столько сама коррозия, сколько загрязнение поверхности ее продуктами (декоративные покрытия, зеркала и пр.). В этом случае самой нежелательной является сплошная коррозия равномерного типа.
Электрохимическая коррозия металлов
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
- Анодного – металл в виде ионов переходит в раствор.
- Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель).
Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
Водородная деполяризация
Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде:
2H++2e— = H2 разряд водородных ионов
2H3O++2e— = H2 + 2H2O
Кислородная деполяризация
Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде:
O2 + 4H++4e— = H2O восстановление растворенного кислорода
O2 + 2H2O + 4e— = 4OH—
Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов:
- Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители.
- Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах.
- Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители.
- Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей.
Виды электрохимической коррозии
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
- Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
А: Fe – 2e— = Fe2+
K: O2 + 4H+ + 4e— = 2H2O
Катодом является та поверхность, где больше приток кислорода.
- Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
- Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
- Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
- Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла.
- Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Защитные краски для металла
Нанесение на металлическую поверхность специальных защитных красок — одно из самых эффективных средств против коррозии. При высыхании они образуют твердую пленку с пигментами. Толщина этой пленки может варьироваться в зависимости от назначения металлического изделия. Толщина и характер взаимодействия краски с поверхностью определяют защитные свойства покрытия.
Антикоррозионные средства по металлу можно разделить на три группы:
- грунтовки;
- краски;
- средства для нанесения прямо поверх ржавчины.
Выбирая защитную краску, важно учитывать свойства металлической поверхности, на которую она будет наноситься. Например, для черных металлов, таких как сталь, лучше выбрать грунтовку, содержащую цинк. Дело в том, что оцинкованная поверхность в течение долгого времени способна противостоять разрушениям. Как правило, инструкция содержит информацию о том, для какого типа поверхности предназначается данный продукт.
Краска по ржавчине становится удачным решением в ситуации, когда поверхность невозможно качественно очистить от ржавчины. Она проста и удобна в использовании, ложится ровным плотным слоем. Покрытие, которое создает такая краска, отличается прочностью и устойчивостью к коррозии. Несмотря на то что на металлической поверхности уже имеются коррозионные очаги, краска по ржавчине не позволит им увеличиваться и распространяться.
Большинство средств подходят для того, чтобы наносить их вручную в бытовых условиях. Некоторые краски лучше ложатся, если их распылять. В составе красок учитывают то, что они будут использоваться в том числе для защиты конструкций, находящихся на улице. Средства можно наносить в уличных условиях. Как правило, антикоррозионные краски для лучшего эффекта наносят достаточно толстым слоем.
Окрашенная поверхность выглядит эстетично. При этом она надежно защищена от коррозии. Образовавшаяся в результате окрашивания пленка предотвращает отрицательное влияние света, влаги, примесей в атмосфере. Защита поверхности от окисления обеспечивается на срок до 8 лет.
Методы защиты от коррозии металла
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях. Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Неметаллические покрытия
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия
В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.);
фосфатирование – получение защитной пленки фосфатов (Fe3(PO4)2, Mn3(PO4)2);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с органическими веществами;
цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла и коррозионной среды
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
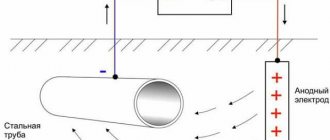
Электрохимическая защита
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Примеры задач с решениями на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов, а также уравнения реакций, протекающих при электрохимической коррозии металлов приведены в разделе Задачи к разделу Коррозия металлов
Категории Коррозия металлов, ОБЩАЯ ХИМИЯ
Нормы и правила СНиП
Защита металлических конструкций от разрушения на предприятиях — это технологический процесс, при котором необходимо соблюдать установленные нормы. Официальный документ, который регулирует нормы и правила при антикоррозионных работах — СНиП 2.03.11—85.
Данный документ указывает допустимые методы обработки металлических поверхностей для предотвращения коррозии. Они включают:
- покрытие лакокрасочными материалами;
- пропитку антикоррозионным составом;
- оклейку специальными защитными пленками.
При выполнении защитных работ документ предписывает учитывать особенности среды: степень агрессивности, физическое состояние и характер действия. Для разных сред предусмотрено использование материалов, которым можно обеспечить эффективную защиту от разрушения.
Если обработка металлоконструкций от разрушения проводится самостоятельно, рекомендации и правила из СНиП необходимо учитывать.
На Череповецком заводе металлоконструкций все работы по предотвращению коррозии начиная от соответствующего проектирования и заканчивая послемонтажным обслуживанием, проводятся с учетом госстандартов и правил. Уверенность в высоком качестве металлоконструкций позволяет давать нашим клиентам гарантию до 24 месяцев на всю продукцию.
Подведем итоги
В этой статье мы рассмотрели виды химической коррозии и то, чем она отличается от электрохимической. При условии соблюдения ряда требований, удается заметно уменьшить риск разрушения металла. К ним относятся такие, как:
- Контроль формирования защитной оксидной пленки.
- Исключение контакта определенных материалов с агрессивными средами.
- Использование дополнительных защитных покрытий.
- Отслеживание состава газовой смеси или электролита.
- Применение металлов с компонентами сплава, замедляющими реакцию.
Соблюдение перечисленных требований позволит значительно увеличить длительность использования вашего металлического изделия.
Вернуться к статьям Поделиться статьей