Понятие о металлургии: общие способы получения металлов
Металлургия — это наука о промышленных способах получения металлов. Различают черную и цветную металлургию.
Черная металлургия — это производство железа и его сплавов (сталь, чугун и др.).
Цветная металлургия — производство остальных металлов и их сплавов.
Широкое применение находят сплавы металлов. Наиболее распространенные сплавы железа — чугун и сталь.
Чугун — это сплав железа, в котором содержится 2-4 масс. % углерода, а также кремний, марганец и небольшие количества серы и фосфора.
Сталь — это сплав железа, в котором содержится 0,3-2 масс. % углерода и небольшие примеси других элементов.
Легированные стали — это сплавы железа с хромом, никелем, марганцем, кобальтом, ванадием, титаном и другими металлами. Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность.
Основные стадии металлургических процессов:
- Обогащение природной руды (очистка, удаление примесей)
- Получение металла или его сплава.
- Механическая обработка металла
Большинство металлов встречаются в природе в виде соединений. Наиболее распространенный металл в земной коре — алюминий. Затем железо, кальций, натрий и другие металлы.
| Нахождение металлов в природе | ||
| Активные металлы — в виде солей | Металлов средней активности — в виде оксидов и сульфидов | Малоактивные металлы -в виде простых веществ |
| Хлорид натрия NaCl | ||
Активные металлы (щелочные и щелочноземельные) классическими «химическими» методами получить из соединений нельзя. Такие металлы в виде ионов — очень слабые окислители, а в простом виде — очень сильные восстановители, поэтому их очень сложно восстановить из катионов в простые вещества. Чем активнее металл, тем сложнее его получить в чистом виде — ведь он стремится прореагировать с другими веществами.
Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях.
Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl = 2Na + Cl2
Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С:
KCl + Na = K↑ + NaCl
Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl = 2Cs + CaCl2
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
MgCl2 → Mg + Cl2
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
CaCl2 → Ca + Cl2
Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C:
4BaO+ 2Al = 3Ba + Ba(AlO2)2
Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6:
2Al2O3 → 4Al + 3O2
Металлы малоактивные и неактивные восстанавливают из оксидов углем, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают.
Понятие о металлургии
Металлургия — получение металлов из руд — один из древнейших видов человеческой деятельности. Еще во втором тысячелетии до н. э. в Египте умели выплавлять железо из железной руды. Так называемый железный век пришел на смену бронзовому, тот, в свою очередь, наступил после каменного.
Получают металлы из рудных полезных ископаемых. Например, халькопирит или медный колчедан — сырье для производства железа, меди и серы (Рис. 1). Химическая формула минерала CuFeS2. Металлы в составе других руд находятся в виде оксидов или солей неорганических кислот, химически связанных катионов.
Рис. 1. Халькопирит
Суть металлургического процесса заключается в восстановлении положительных ионов до свободных атомов металла. Используют в качестве источников электронов углерод и его соединения, водород, металлы. В процессе восстановления катионы получают недостающие электроны. Происходит восстановление электронных оболочек металла. Схема процесса:
Ме+n + ne- → Me, где
- Ме+n — металл в окисленной форме;
- +n — степень окисления;
- ne- — количество присоединяемых электронов;
- Ме — металл в восстановленной форме.
Пирометаллургия
Пи́рометаллу́ргия
— совокупность металлургических процессов, протекающих при высоких температурах. Это отрасль металлургии, связанная с получением и очищением металлов и металлических сплавов при высоких температурах, в отличие от гидрометаллургии, к которой относятся низкотемпературные процессы.
Описание[ | ]
Это химические процессы, протекающие в металлургических агрегатах при высоких (800—2000°С) температурах. Поэтому пирометаллургию иногда называют «химией высоких температур».
Часто химические реакции сопровождаются изменением агрегатного состояния реагирующих веществ: плавлением, возгонкой, испарением образующихся металлов или их соединений.
В таких процессах взаимодействия могут протекать между твёрдой, жидкой (расплавы) и газообразной фазами в любых сочетаниях.
Пирометаллургическими процессами являются процессы агломерации металлургического сырья, плавки шихтовых материалов, изготовления сплавов, рафинирования металлов. В частности, это — обжиг, доменная плавка, , плавка в конвертерах, дуговых и индукционных печах.Пирометаллургия — основа производства чугуна, стали, свинца, меди, цинка и др.
В пирометаллургии часто применяется восстановление углеродом — в тех случаях, когда восстанавливаемые металлы не образуют устойчивых карбидов, помимо указанных выше, к таким металлам относятся германий, кадмий, олово и другие. В случаях образования восстанавливаемыми металлами устойчивых карбидов вместо восстановления углеродом часто применяется металлотермия[1].
Пирометаллургия — основная и наиболее древняя область металлургии. С давних времён до конца 19 столетия производство металлов базировалось почти исключительно на пирометаллургических процессах.
На рубеже 19 и 20 столетий промышленное значение приобрела другая крупная ветвь металлургии — гидрометаллургия.
Однако пирометаллургия продолжает сохранять господствующее положение как по масштабам производства, так и по разнообразию процессов.
В начале 20 столетия вместе с пламенными способами нагрева в металлургии начали использоваться разные виды электрического нагрева (дуговой, индукционный и др.); приблизительно в это же время в промышленности был внедрён электролиз расплавленных химических соединений (производство алюминия и других цветных металлов).
Во 2-й половине 20 столетия получили распространение плазменная плавка металлов, зонная плавка и . Металлургические процессы, основанные на использовании электрического тока, выделяют в самостоятельную область пирометаллургии — электрометаллургию.
Основные процессы[ | ]
Основным процессом пирометаллургии является рудная плавка, которая проводится при таких высоких температурах, когда продукты химического взаимодействия расплавляются, образуя две жидкие фазы — металлическую или сульфидную и шлаковую. Различают восстановительную и окислительную плавки.
Определяющий процесс восстановительной рудной плавки — это восстановление оксидов металла с получением в конечном итоге расплава металла или его сплава с другими элементами. Типичной восстановительной плавкой является получение чугуна в доменных печах. Восстановительные процессы являются также главными при плавке марганцевых, окисленных никелевых, свинцовых, титановых руд.
Основными реагментами-восстановителями служат углерод, оксид углерода и водород. Оксид углерода образуется в самой печи при неполном горении углерода; основное количество водорода получается в результате разложения вдуваемого в печь природного газа.
Разновидностью восстановительных плавок является металлотермическое получение металлов, при котором в качестве восстановителя какого-то металла (Mn, Cr, V и др.) используется другой металл — с большим сродством к кислороду: Ca; Mg; Al, а также Si. Одним из достоинств металлотермического восстановления является получение металлов, не загрязненных углеродом или водородом.
Типичной окислительном рудной плавкой является переработка в шахтных печах богатых медных сульфидных руд. В ходе плавки окисляется основная доля серы сульфидных минералов, в результате чего выделяется значительное количество тепла. Основным целевым продуктом плавки является расплав сульфидов FeS и Cu2S — штейн.
Чугун и штейн рудных плавок являются, по-существу, полупродуктами, которые требуют дополнительной обработки. Такая обработка заключается в продувке расплавов воздухом или чистым кислородом, в результате чего содержащиеся в сплавах примеси окисляются и переходят либо в шлак (SiO2; MnO; FeO и др.), либо в газ (СО; SO2). Процесс называется конвертированием.
Аналогичным конвертированию является фьюминг-процесс — продувка газом шлаковых расплавов. Отличие его от конвертирования состоит в том, что металлический расплав продувают окислительным газом, а при фьюминговании шлака восстановительным.
А во-вторых, продукты окисления металлического расплава — оксиды металлов — образуют вторую жидкую фазу — шлак, а продукты фьюмингования шлака — восстановленные легколетучие металлы (или сульфиды) в парообразном состоянии удаляются из реакционного пространства газовым потоком[2].
Литература[ | ]
Способы получения металлов
В зависимости от того, кокой восстановитель используют в металлургическом процессе различают: пиро — , гидро, электро — и биометаллургию.
Наиболее распространенные способы получения металлов: пирометаллургический и электрометаллургический. Большинство реакций восстановления протекают при высоких температурах (Рис. 2). Так как металлическая связь обладает повышенной прочностью, то выделение металлов в чистом виде из природных соединений проводят при высоких температурах.
Рис. 2. Металлургическое производство
Пирометаллургический способ
Пирометаллургия — получение металлов из руд при высоких температурах при участии восстановителей. В переводе с греческого «пирос» означает «огненный». Используют в качестве восстановителей кокс, диоксид углерода, водород. Применяют активные металлы для получения менее активных.
Пирометаллургия подразделяется на
- карботермия,
- водородотермия,
- металлотермию.
Карботермия: перевод сульфида металла путем обжига в оксид и дальнейшим восстановлением углем до чистого состояния.
2ZnS + 3O2 = 2ZnO + 2 SO2
ZnO + C = CO + Zn
Руды, состоящие из оксидов и сульфидов железа, подвергают карботермии. Проводят восстановление коксом или диоксидом углерода (угарным газом). Получают сплавы железа — чугун и сталь. Первый содержит больше углерода, а также оксидов серы, фосфора и кремния. Углерод снижает твердость и другие характерные для металлов качества.
Химические реакции, лежащие в основе выплавки чугуна:
- C + O2 = CO2↑,
- CO2 + C ↔ 2CO↑,
- 3Fe2O3 + CO = 2Fe3O4+ CO2↑,
- Fe3O4 + CO = 3FeO + CO2↑,
- FeO + CO = Fe + CO2↑.
Сталь выплавляют в специальных печах — электрических, конвертерных, мартеновских (Рис. 3). При продувании обогащенного кислородом воздуха выгорает избыточный углерод, его содержание уменьшается до 2% и ниже. Этот способ является более экономически применим, т.к. при помощи него получают сталь и чугун, которые широко используются в современной промышленности.
Рис. 3. Пирометаллургия
Восстановлением углем можно получить железо, медь, цинк, кадмий, германий, олово, свинец и другие металлы. В качестве сырья используют медную (Cu2O), оловянную (SnO2), марганцевую (MnO2) руды.
| Схема получение железа и хрома | (Cr2Fe)O4 + 4C(кокс) = Fe + 2Cr + 4CO↑ |
| Реакция, лежащая в основе выплавки меди | Cu2O + C (кокс) = 2Cu + CO↑ |
| Схема производство олова | SnO2 + 2C (кокс) = Sn + 2CO↑ |
| Процесс выплавки марганца | MnO2 + C(кокс) = Mn + CO2↑ |
| Схема получения свинца | 2PbO + C → Pb + CO↑ |
Металлы можно извлечь из сульфидных руд. Сначала проводят обжиг, затем — восстановление полученного оксида углем. Схемы обжига цинковой обманки и получение цинка:
- 2ZnS +3O2 = 2ZnO + 2SO2↑;
- ZnO + C = Zn + CO↑.
Карбонаты тоже прокаливают с углем для получения оксидов и последующего восстановления углем. Схемы обжига сидерита и восстановления оксида железа:
- FeCO3 = FeO + CO2↑;
- FeO + C = Fe + CO↑.
Водородотермия — производство металлов восстановлением водородом
Достоинством этого металлургического метода является получение очень чистых металлов. Восстановление меди из оксида CuO — пример восстановительных свойств водорода из школьного курса неорганической химии. Схема протекания реакции (Рис 4):
Рис. 4. Восстановление меди водородом
Водородом восстанавливают из оксидов тугоплавкие металлы молибден и вольфрам.
Металлотермия
Проводят восстановление одного металла другим, более химически активным. Этот способ применяют для получения металлов из оксидов и галогенидов.
В зависимости от природы металла-восстановителя различают алюминотермию, или алюмотермию, — восстановление алюминием и магнийтермию — восстановление магнием.
| Схема получение марганца | 3MnO2 + 4Al = 3Mn + 2Al2O3 |
| Процесс выплавки хрома | Cr2O3 + 2Al → 2Cr + Al2O3 |
| Схема получение кальция | 4CaO+ 2Al= 2Ca+ (CaAl2)O4 |
Силикотермия — восстановление металлов кремнием. Процесс протекает согласно схеме: 2MgO + Si → 2Mg + SiO2.
3.2. Восстановление металлов углем
Чистые металлы можно получить восстановлением из оксидов углем. При этом до металлов восстанавливаются только оксиды металлов, расположенных в ряду электрохимической активности после алюминия.
Например, железо получают восстановлением из оксида углем:
2Fe2O3 + 6C → 2Fe + 6CO
ZnO + C → Zn + CO
Оксиды металлов, расположенных в ряду электрохимической активности до алюминия, реагируют с углем с образованием карбидов металлов:
CaO + 3C → CaC2 + CO
Гидрометаллургический способ
Гидрометаллургия — способ получения благородных, цветных, редких металлов. Например, оксид меди сначала переводят в сульфат с помощью серной кислоты. Медь вытесняют из раствора железом. Протекает следующая реакция замещения: CuSO4 + Fe = Cu + FeSO4. Либо медь извлекают из раствора электролизом. Пропускают электрический ток, ионы Cu2+ осаждаются на катоде.
Преимущество гидрометаллургического способа — возможность получать металлы из бедных руд. Еще один плюс метода — снижение газообразных выбросов в атмосферу. Большое количество вредных газов и сажи поступает в воздух при обжиге руды и пирометаллургии.
Общие характеристики сплавов металлов
А сейчас мы рассмотрим общие свойства металлов и сплавов, которыми те характеризуются. Их же очень часто можно встретить в специализированной литературе.
| Характеристика | Расшифровка |
| Прочность | Способность сплава противостоять механическим нагрузкам и противиться разрушению. |
| Твердость | Свойство, которое определяет сопротивляемость материала попыткам внедрить в его толщу деталь из другого сплава или металла. |
| Упругость | Способность к восстановлению начальной формы после приложения значительного механического усилия, нагрузки. |
| Пластичность | Напротив, это свойство, характеризующее возможность изменения формы и размером под действием приложенного усилия, механической нагрузки. Кроме того, это оно же характеризует способность детали сохранять вновь приобретенную форму на протяжении длительного времени. |
| Вязкость | — способность металла оказывать сопротивление быстро возрастающим (ударным) нагрузкам |
Вот какими качествами характеризуются сплавы металлов. Таблица поможет вам в них разобраться.
Достоинства и недостатки магниевых сплавов
Они довольно мягкие, сравнительно неплохо сопротивляются износу, но отличаются не слишком впечатляющей пластичностью. Зато они отличаются прекрасной приспособленностью к формовке в условиях высоких температур, отлично приспособлены для соединения с использованием всех существующих разновидностей сварок, а также могут быть соединены посредством болтовых соединений, клепки и даже склеивания.
Увы, но все эти сплавы не отличаются особенной стойкостью к воздействию кислот и щелочей. Крайне негативно на них воздействует долгое пребывание в морской воде. Впрочем, магниевые сплавы на удивление стабильны в условиях воздушной среды, так что многими их недостатками можно пренебречь. Если же требуется надежно защитить такие детали от действия коррозии, то применяют нанесение хромового покрытия, анодирование или подобные же методы.
Их можно плакировать при помощи никеля, меди или хрома, предварительно погружая в расплав химически чистого цинка. При такой обработке резко возрастают показатели их прочности и устойчивости к истиранию. Нужно напомнить, что магний является довольно-таки активным с химической точки зрения металлом, а потому при работе с ним необходимо соблюдать хотя бы базовые меры безопасности.
Таким образом, производство металлов и сплавов является ключевой особенностью современной промышленностью. С каждым годом люди изобретают все больше способов получения новых материалов, так что вскоре мы наверняка получим совершенно невероятные соединения, которые будут сочетать в себе полезные свойства сразу нескольких групп материалов и химических элементов.
Сплавы на основе алюминия
Как мы уже говорили, без них современную промышленность представить себе решительно невозможно. Судите сами: сплавы алюминия активно применяются в авиационной, космической, военной, научно-инженерной и прочих отраслях. Без алюминия невозможно представить себе производителей современной бытовой и мобильной техники, так как корпуса из этого металла все чаще используются современными флагманами этих отраслей.
Сплавы свинца
Вообще цветные металлы и сплавы – неразделимо связанные понятия, так как с древнейших времен люди умели выплавлять многосоставные материалы, которые с успехом использовали в военном и мирном деле. Особенно это относится к свинцу, из сплавов которого еще римляне делали водопроводы и канализации. Конечно, они не знали о токсических свойствах этого металла, но им импонировала простота его обработки.
Наиболее известен в настоящее время обычный припой, который изготавливается из одной части свинца и двух частей олова. Как видно из названия, он используется для пайки деталей. Применяется в радиотехнике и прочих технических отраслях. Из сурьмы и свинца делают сплавы, которые используются для изготовления оболочек разного рода кабелей.
Давно известно, что соединения этого металла с кадмием, висмутом или оловом могут плавиться приблизительно при температуре 70 градусов по шкале Цельсия. Именно поэтому сегодня из них делают различные предохранители в системах автоматического пожаротушения.
Как ни странно, но свинец издавна был известен поварам и рестораторам, так как из него нередко делали столовую посуду и приборы. Сплав, который использовался для этого, называется пьютер. В его состав входит приблизительно 85–90% олова. Оставшиеся 10-15% как раз-таки занимает свинец (стандартный сплав двух металлов).
Техники также наверняка знакомы с баббитами. Это также соединения на основе свинца, в состав которых также входит олово, а также мышьяк и сурьму. Эти сплавы весьма ядовиты, но из-за некоторых особых качеств их активно используют в подшипниковой отрасли промышленности.
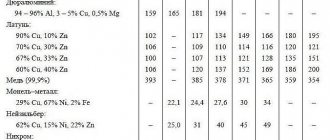
Медные сплавы
Чаще всего под этим термином понимаются разные сорта латуни. Это такие сплавы меди, в которых содержится от 5 до 45% цинка. Если его содержание колеблется в пределах 5-20%, то это красная латунь (томпак). Если же в материале содержится уже 20–36% Zn, то это – желтая латунь.
Эти материалы идеальны в случае необходимости производства и формовки мелких деталей. Малоизвестно, но сплав меди с кремнием носит название кремнистой бронзы и обладает большой механической прочностью. Практически тем же характеризуется фосфористая разновидность (к меди прибавляется 5% олова и некоторое количество фосфора). Как и в прошлом случае, отличается высокой прочностью и пружинистыми качествами, а потому идеальна для изготовления мембран и разного рода пружин.
Сплавы магния
Они имеют крайне невысокую массу, а также характеризуются весьма впечатляющей прочностью. Кроме того, именно эти материалы великолепно подходят для литейной промышленности, а заготовки прекрасно поддаются токарной и фрезеровочной обработке. А потому их активно используют в производстве ракет и авиационных турбин, корпусов приборов, дисков автомобильных колес, а также некоторых сортов броневой стали.
Некоторые разновидности этих сплавов отличаются великолепными показателями вязкостного демпфирования, а потому они идут на производство деталей и конструкций, которым приходится работать в условиях экстремально высокого уровня вибраций.
О легких сплавах
Как мы уже говорили, свойства металлов и сплавов отличаются тем, что у вторых во многих случаях характеристики выше. Особенно это заметно в отношении современной промышленности. В последние годы ей требуется огромное количество легких сплавов, которые обладают повышенной механической прочностью, а также устойчивостью к воздействиям неблагоприятных факторов внешней среды и высокой температуре.
Чаще всего для их производства используется алюминий, бериллий, а также магний. Особенно востребованы соединения на основе алюминия и магния, так как сфера их возможного применения чрезвычайно широка.
Стали
Все соединения железа, содержащие до 2% углерода, называются сталями. Если в составе имеется хром, ванадий или молибден, то их называют легированными. С этими материалами мы сталкиваемся постоянно, ежедневно и ежечасно. Количество сталей на сегодняшний день таково, что одно их перечисление могло бы занять не слишком тонкую книгу.
Мы уже говорили, что механические свойства металлов и сплавов сильно отличаются, но в случае этих материалов нередко противоположными качествами обладают даже различные виды сталей, отчего сферы их применения сильно расходятся.
Если в материале менее 0,25% углерода, то он используется в каких-то технических конструкциях. Если же в стали более 0,55% углерода, то она идеально подходит для производства различных высококачественных режущих инструментов, в том числе резцов для токарных станков, сверл и хирургических принадлежностей. Но если речь идет о приспособлениях, которые применяются для быстрой резки, то на их производство идет исключительно легированная сталь.