- Характеристики
- Сферы применения
- Правила работы
- Применение от ржавчины
- Применение для металла
Нередко металл и изделия из него подвергаются характерной «болезни», которая проявляется в виде рыжего налета, разъедающего металл. Речь идет о ржавчине. Ее образование происходит благодаря воздействию на поверхность металлического изделия углекислого газа, кислорода и воды. Безусловно, для того чтобы продлить срок службы изделия из металла необходимо как можно скорее начать борьбу с коррозией. Помочь в этом может обработка ортофосфорной кислотой.
Физические свойства
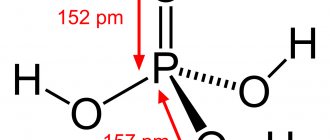
Фосфорная (ортофосфорная) кислота с молярной массой 97,99 г/моль и эмпирической формулой H3PO4 — неорганическая трёхосновная кислота средней силы. Структурная формула молекулы в газообразном агрегатном состоянии описывается в виде тетраэдра, содержит в центре атом фосфора, а в вершинах — атом кислорода и три гидроксильные группы.
Состав следующий:
| Наименование | Количество атомов | Массовая доля, % |
| Водород (H) | 3 | 3,10 |
| Фосфор (P) | 1 | 65,30 |
| Кислород (O) | 4 | 31,60 |
При нормальных условиях бесцветные кристаллы гигроскопичны, плавятся на воздухе уже при 42,35 °C, легко растворяются в воде, этиловом спирте и других растворителях. Практическое применение имеют водные растворы трёх видов:
| Концентрация, % | Температура плавления, °C | Плотность, грамм/мл |
| 75 | -20 | 1,579 |
| 80 | 0 | 1,633 |
| 85 | +20 | 1,689 |
Сиропообразная жидкость без цвета и запаха 85%-й концентрации H3PO4 обычно и называется ортофосфорной кислотой, а кипячением в вакууме при 80 °C из неё выделяется безводная составляющая. В твёрдой фазе и в высококонцентрированных растворах молекулы фосфорной кислоты образуют межмолекулярные водородные связи.
При разбавлении на первое место выдвигаются водородные связи между фосфат-анионами PO43- и молекулами воды H2O.
Правила транспортировки
Существуют специальные ГОСТы, оговаривающие правила перевозки кислоты ортофосфорной, которая относится к опасным грузам. Вещество может доставляться любым видом транспорта. Химически активная жидкость перевозится в плотно закрытых:
- стальных автоцистернах;
- бутылях из полиэтилена, стекла;
- пластиковых кубах;
- бочках;
- канистрах;
- гуммированных железнодорожных цистернах.
Химические свойства
Растворы H3PO4 имеют различный ионный состав, зависящий от кислотности (pH) среды. Как и для всех среднесильных трёхосновных кислот, электролитическая диссоциация фосфорной кислоты является трёхступенчатой, по первой ступени реакция экзотермическая и сопровождается выделением тепла, а по второй и третьей — эндотермическая:
- H3PO4 = H+ + H2PO4-.
- H2PO4- = H+ + HPO42-.
- HPO42- = H+ + PO43-.
Соответственно, и соли бывают как средними — фосфаты, так и кислыми — гидрофосфаты и дигидрофосфаты.
При комнатной температуре H3PO4 ведёт себя достаточно инертно, при нагревании проявляет кислотные свойства средней силы и изменяет цвет индикаторов на красный. Она реагирует с металлами, стоящими в ряду активности до водорода: 3Al + 2H3PO4 = Al3 (PO4)2 + 3H2. Вступает в реакции нейтрализации с гидроксидами: 3NaOH + H3PO4 = Na3PO4 + 3Н2О; в реакции обмена — с основными оксидами: 3MgO + 2H3PO4 = Mg3 (PO4)2 + 3H2O.
Нагревание выше 80 °C способствует взаимодействию с пассивными оксидами и силикатами. Поэтому в металлургии широко применяется процесс фосфатирования: защитная плёнка фосфатов образуется на поверхности чугунных, стальных или медных изделий, улучшая их характеристики. Повышение температуры приводит к дегидратации молекулы с образованием пирофосфорной и метафосфорной кислоты:
- 2H3PO4 = H2O + H4P2O7;
- H4P2O7 = H2O + 2HPO3.
Дальнейшее нагревание увеличивает длину цепи, и в результате образуются полифосфорные кислоты (НРО3) n с полимерным строением. Одна только ортофосфорная кислота взаимодействует с нитратом серебра, образуя ярко-жёлтый осадок, тогда как остальные дают белый: H3PO4 + 3AgNO3 = Ag3PO4 + 3HNO3. Поэтому осаждение фосфата серебра служит качественной реакцией на фосфат-ион.
Глобальный рынок
Многие развивающиеся страны начали сосредотачиваться на увеличении добычи фосфатов и производства фосфатов. Правительства некоторых стран уже сотрудничали с различными поставщиками по всему миру для создания заводов по добыче минералов для производства фосфорной кислоты. В 2022 году объем мирового рынка фосфорной кислоты оценивался в 45,85 миллиарда долларов. Ожидается, что к 2027 году он достигнет более 61 миллиарда долларов, а совокупный годовой темп роста составит 3,7%.
Рынок подразделяется на Азиатско-Тихоокеанский регион, Европу, Северную Америку, Латинскую Америку, Ближний Восток и Африку. Ожидается, что в ближайшем будущем Азиатско-Тихоокеанский регион будет доминировать на мировом рынке. Рост рынка фосфорной кислоты в этих регионах будет дополнительно подпитываться развитым сельскохозяйственным сектором Индии и Китая.
Основные способы получения
Впервые в далёком 1694-м английскому химику Роберту Бойлю удалось синтезировать фосфорную кислоту с применением оксида фосфора (V). Простой метод окисления фосфора разбавленной азотной кислотой и до сегодняшних дней широко используется в лабораториях: 3P + 5NO3 +2H2O = 3H3PO4 + 5NO. Нагревание до кипения безводной фосфористой кислоты приводит к разложению её на ядовитый газ фосфин и ортофосфорную кислоту: 4H3PO3 = 3H3PO4 + PH3.
Промышленное значение имеют два варианта получения: термический и экстракционный. Первый заключается в окислении элементарного фосфора при сжигании до оксида (V): P4 + 5O2 = P4O10; и обработке конечного продукта водой: P4O10 + 6H2O = 4H3PO4.
Технически это реализуется различными способами, названными по аббревиатуре запатентовавших компаний:
- IG-процесс объединяет обе реакции в одной колонне, изготовленной из нержавеющей стали с низким процентным содержанием углерода. Фосфор подаётся сверху при помощи сжатого воздуха или пара и сгорает при температурах свыше 2000 °C. Продукт реакции, оксид фосфора (V), поглощает ортофосфорная кислота, равномерно стекающая по стенкам колонны. Она выполняет одновременно несколько важных функций: растворение P2O5, отведение тепла из зоны горения, защита стенок от пламени. Готовая кислота собирается внизу, охлаждается в теплообменнике и снова поступает в колонну. Продукт IG-процесса практически не имеет в составе низших фосфорных соединений, но требует удаления примесного мышьяка, который всегда загрязняет любой фосфор. Эту проблему решает сероводород: он выделяется при введении в раствор сульфида натрия и осаждает сульфид мышьяка, а затем следует фильтрация.
- TVA-процесс предусматривает отделение процесса горения фосфора от поглощения его оксида. В стальной камере сгорания с внешним охлаждением фосфор соединяется с воздухом, затем продукты реакции подпадают в камеру поглощения, где и становятся ортофосфорной кислотой.
- Хёхст-процесс сгорание и поглощение тоже осуществляет раздельно, но утилизирует теплоту реакции горения для генерирования рабочего пара.
При экстракционном способе производства в России природные фосфаты (апатитовые концентраты из Хибин или фосфориты Каратау) обрабатывают водными растворами неорганических кислот. Это позволяет обеспечивать растущие потребности страны в минеральных удобрениях. Образующийся сульфат кальция присоединяет различное количество молекул воды в зависимости от условий, и по этим признакам экстракционные процессы делят на несколько видов:
- Дигидратные (CaSO4·2H2O). Сырьё измельчают и при температуре от 70 до 80 °C подают в реактор отдельно от серной кислоты. Концентрация готового продукта достигается порядка 30%, а сульфат кальция получается в виде дигидрата. Преимущества: относительно низкая температура, позволяющая избежать коррозии; разнообразие используемых фосфатов; переработка больших количеств. Недостатки: исходное сырьё требует предварительной подготовки (размол), а полученный продукт нуждается в дополнительной концентрации.
- Гемигидратные (CaSO4·0,5H2O). Проводятся при более высоких температурах (от 80 до 100 °C), что позволяет получить устойчивую форму кристаллогидрата — гемигидрат сульфата кальция. Ортофосфорная кислота имеет концентрацию от 40 до 48% и не нуждается в дополнительной обработке.
- Комбинированные гемигидратно-дигидратные процессы — заслуга японских учёных. Сырьё обрабатывается при высоких температурах, а образующийся гемигидрат перекристаллизовывается в дигидрат. Получается практически чистый гипс, побочный продукт реакции. Он с успехом восполняет потребности государственной экономики, не имеющей собственных залежей.
Осаждение безводной соли (ангидритный метод) теоретически осуществимо, но в промышленности не используется, так как вызывает серьёзные коррозионные проблемы.
Для концентрирования дигидратного продукта применяют вакуумное испарение, иногда в нескольких последовательно установленных аппаратах. Это не только экономит теплоноситель, но и удаляет фторсодержащие примеси, которые используют в производстве гексафотросиликата водорода H2SiF6. Прочие неорганические загрязнения, соединения мышьяка и кадмия, удаляют осаждением и экстракцией, а чистая кислота перегонкой освобождается от растворителя.
История открытия
Открытие фосфорной кислоты произошло в XVII веке сразу в нескольких независимых лабораториях.
Первые упоминания об открытии фосфора относятся к немецкому ученому Хенингу Брандту. Разорившийся предприниматель, увлекшись алхимическими опытами в поисках «философского камня», подверг тщательном у изучению продукты человеческой жизнедеятельности. Выпарив мочу, и нагрев оставшийся осадок, Брандт получил белое вещество. Дальнейшие опыты с этим веществом заключающиеся в нагревании без доступа кислорода, помогли выделить легкоплавкое вещество с неприятным запахами и парами, светящимися в темноте. Первое название этого вещества имело очень мистический характер. «Холодный огонь», — именно так назвал свое открытие Хенинг Бранд.
В лаборатории англо-ирландского химика Роберта Бойля известного в научных кругах тем, что предпочитал опыт, а не домыслы в 1680 году фосфор был выделен при помощи опытов с индикаторами. Бойль (с подсказки Крафта) проведя ряд экспериментов с жидкостями, кровью, мочой, волосами и костями, поставил производство фосфора на коммерческую основу.
Производство фосфора в XVII веке имело очень успешный коммерческий характер, из-за связи с алхимическими поисками, но в XVIII веке в связи с обнаружением еще одного способа получения (ученым Маргграфам Андреасам Зигизмундом) и его всесторонним раскрытием, перестало иметь коммерческую привлекательность.
Сферы использования продукта
Многие отрасли народного хозяйства по достоинству оценили свойства фосфорной кислоты. Применение её удивительно разносторонне — от научных исследований в молекулярной биологии до обеспечения хладагентами морозильных установок.
Производство минеральных удобрений потребляет львиную долю экстракционной кислоты, и ежегодно сюда расходуется более 90% фосфорсодержащих руд. Растениям фосфор необходим для образования семян и плодов, его добавки увеличивают резистентность к заморозкам и пересушиванию, что особенно существенно для северных областей с коротким периодом вегетации и слабым развитием почвенных микроорганизмов.
Пищевая промышленность заинтересовалась антиоксидантными и стабилизирующими свойствами фосфорной кислоты и успешно применяет их в составе добавки E338. Это предотвращает прогоркание, регулирует кислотность и продлевает сроки годности, придаёт вкус сиропам, газировке, мармеладу, хлебу и другой выпечке. Споры о вреде и пользе таких компонентов ведутся много лет, но альтернативы никто ещё не предложил, и пока что всё сводится только к разумному потреблению.
Металлообработка широко применяет фосфорную кислоту как флюс при пайке меди, чёрных металлов и нержавеющей стали. Очень эффективна также и очистка поверхностей от ржавчины — образуется защитная плёнка, предотвращающая дальнейшую коррозию.
Органический синтез использует H3PO4 как катализатор, авиационная промышленность включила в состав гидрожидкостей, деревообработка пропитывает древесину, делая её негорючей. В этом послужном списке достойно соседствуют звероводство, осветление сахарозы и изготовление лекарств, производство огнеупорных пропиток и стоматология, где фосфорная кислота применяется для протравливания зубных тканей перед пломбированием.
А ещё — получение активированного угля, огнеупорного стекла и керамики, огнезащитных лакокрасочных материалов, огнестойкого фосфатного пенопласта и древесно-стружечных плит. Соли фосфаты используются для умягчения жёсткой водопроводной воды и входят в состав СМС и средств, удаляющих накипи.
Применение от ржавчины
Преобразователь ржавчины на основе ортофосфорной кислоты создает на поверхности защитный слой, оберегающий от коррозии при дальнейшем использовании. Особенность применения соединения – безопасность для металла при нанесении. Существует несколько способов выполнить удаление ржавчины ортофосфорной кислотой, зависящих от размера повреждения:
- травление с погружением в ванну, иную емкость;
- многократное нанесение на металл состава пульверизатором, валиком;
- покрытие поверхности предварительно обработанной механической очисткой.
Ортофосфорное соединение производит преобразование ржавчины в фосфаты железа. Состав можно использовать для промывки и очистки:
- изделий металлопроката;
- скважин;
- поверхностей трубопроводов;
- парогенераторов;
- систем водоснабжения, отопления;
- змеевиков;
- бойлеров;
- водонагревателей;
- теплообменников;
- котлов;
- деталей машин и механизмов.
Экология и безопасность
Экстракционным способом, наименее энергозатратным, получается до 95% общего количества кислоты, а оставшиеся 5% приходятся на термический метод. Главный производитель и потребитель экстракционной H3PO4 — США (порядка 90% мировых объёмов), далее в этом списке — Россия и Марокко. Отвалы загрязнённого сульфата кальция, образующиеся при экстракционном способе, нуждаются в утилизации.
Сегодня они сваливаются на суше, затапливаются в водоёмах и лишь незначительная часть используется в качестве сырья для переработки. Сокращение производства в 80-х годах прошлого века было вызвано отказом от фосфорсодержащих растворителей и минеральных удобрений, загрязняющих грунтовые воды.
Ортофосфорная кислота не имеет специфического влияния, обладает слабой системной токсичностью и по степени воздействия на организм человека относится ко второму классу опасности по ГОСТ 12 .1.005. При увеличении концентрации её пары вызывают изменения слизистых оболочек и крошение зубов, а также кожные воспаления.
Контакт имеет раздражающее действие при концентрации растворов до 10%, а свыше 25% — коррозионное и ожоговое.
Работа с препаратом требует применения индивидуальные средства защиты (респиратора, резиновых перчаток, специальных очков) и соблюдения личных правил гигиены. Проглатывание больших количеств вызывает тошноту, диарею и рвоту. Для ликвидации последствий кожные покровы и глаза промывают тёплой водой или физраствором и внутривенно восполняют потери жидкости.
Правила работы с кислотой
Работа с ортофосфорной кислотой должна происходить в помещении с хорошей вентиляцией. Следует обязательно надеть респиратор для предотвращения попадания едких паров в дыхательные пути и очки для защиты глаз. Если нет под рукой этих защитных средств, то следует воспользоваться маской. Обязательно следует надевать перчатки и защищать открытую поверхность кожи от попадания на нее вещества, т. к. это может привести к ожогам. При попадании ее на кожные покровы следует тщательно промыть их под проточной водой, после чего обратиться за медицинской помощью.
Перевозка реагента должна осуществляться в специальном транспорте, оборудованном железными цистернами, не поддающимися ее разрушительному влиянию. Ее можно перевозить и при помощи других транспортных средств, как сухопутных, так и водных. Но при этом должны быть соблюдены все правила техники безопасности.
Хранить ее следует в месте, защищенном от прямого попадания солнечных лучей. Срок хранения при таких условиях составляет не больше 1 года.
Кристаллические решётка:
| 300 | Кристаллическая решётка |
| 311 | Кристаллическая решётка #1 |
| 312 | Структура решётки |
| 313 | Параметры решётки |
| 314 | Отношение c/a |
| 315 | Температура Дебая |
| 316 | Название пространственной группы симметрии |
| 317 | Номер пространственной группы симметрии |