Карбид кальция – соединение кальция с углеродом, представляющее собой твердое кристаллическое вещество. Его получают путем сплавления оксида кальция с коксом в электрических печах (при температурах 1900-1950°С) и последующего затвердевания в специальных формах (изложницах), дробления и сортирования на куски определенных размеров (мелкого, среднего и крупного).
Таким образом происходит образования технического продукта с грязной темно-серой или коричневой окраской из-за 20-25 % содержания примесей (угля и других красящих веществ). Кроме того, в его составе присутствуют сульфид и фосфид кальция, из-за которых материал имеет неприятный запах.
Хорошо поглощает воду и при взаимодействии с ней даже при низких температурах разлагается и бурно выделяет газ ацетилен (acetylene gas) с большим количеством тепла. Разложение вещества может спровоцировать даже атмосферная влага.
Физические свойства
- Бесцветные тетрагональные кристаллы.
- Плотность: 228 (+20 °C, г/см3).
- Удельная теплоёмкость при постоянном давлении (в Дж/г·K): 0,92 (+20—325 °C).
- Стандартная энтальпия образования ΔfH (298 К, кДж/моль): −62,8 (т).
- Стандартная энергия Гиббса образования ΔfG (298 К, кДж/моль): −67,8 (т).
- Стандартная энтропия образования S (298 К, Дж/моль·K): 70,3 (т).
- Стандартная мольная теплоёмкость Cp (298 К, Дж/моль·K): 62,34 (т).
- Энтальпия плавления ΔHпл (кДж/моль): 32,2.
- Карбид кальция имеет резкий чесночный запах.
Производство [ править ]
Карбид кальция производится промышленным способом в электродуговой печи из смеси извести и кокса при температуре около 2200 ° C (3990 ° F). [6] Это эндотермическая реакция, требующая 110 килокалорий (460 кДж) на моль [7] и высоких температур для удаления монооксида углерода. Этот метод не изменился с момента его изобретения в 1892 году:
CaO + 3 C → CaC 2 + CO
Высокая температура, необходимая для этой реакции, практически недостижима при традиционном сжигании, поэтому реакцию проводят в электродуговой печи с графитовыми электродами. Полученный карбидный продукт обычно содержит около 80% карбида кальция по весу. Карбид измельчается с образованием небольших комков размером от нескольких до 50 мм. Примеси концентрируются в более мелких фракциях. Содержание CaC 2 в продукте определяют путем измерения количества ацетилена, образующегося при гидролизе. Например, британские и немецкие стандарты содержания более крупных фракций составляют 295 л / кг и 300 л / кг соответственно (при давлении 101 кПа и температуре 20 ° C (68 ° F)). Примеси, присутствующие в карбиде, включают фосфид, который производит фосфин.при гидролизе. [8]
Эта реакция была важной частью промышленной революции в химии и стала возможной в Соединенных Штатах в результате огромного количества недорогой гидроэлектроэнергии, производимой на Ниагарском водопаде до начала 20-го века. [9]
Метод производства в электродуговой печи был открыт в 1892 году Т.Л. Уилсоном и независимо от него Х. Муассаном в том же году. [10] [11] [12] В Боснии и Герцеговине, в городе Яйце, австрийский промышленник доктор Йозеф Кранц и его
, преемником которой позже стала
«Электро-Босна»
, открыли крупнейший химический завод по производству карбида кальция в то время в Европе в 1899 году. Гидроэлектростанция на Пливедля электроснабжения завода построена река с установленной мощностью 8 МВт. Это была первая в своем роде электростанция в Юго-Восточной Европе, которая была введена в эксплуатацию 24 марта 1899 года [13].
Внешний вид и характеристики технического карбида кальция
Карбид кальция получают сплавлением в электрических печах кокса и негашеной извести. Расплавленный карбид кальция выпускается из печи в специальные формы — изложницы, в которых он затвердевает. Застывший карбид кальция дробится и сортируется на куски определённых размеров.
Технический карбид кальция представляет собой твёрдое кристаллическое вещество. По внешнему виду карбид кальция представляет собой твёрдое вещество тёмно-серого или коричневого цвета. Он даёт кристаллический излом серого цвета с различными оттенками в зависимости от чистоты. Карбид кальция жадно поглощает воду. При взаимодействии с водой даже на холоде карбид кальция разлагается с бурным выделением ацетилена и большого количества тепла. Разложение карбида кальция происходит и под влиянием атмосферной влаги.
По ГОСТ 1460-56 установлены следующие размеры (грануляция) кусков карбида кальция: 2×8; 8×15; 15×25; 25×80. Технический карбид кальция содержит до 80 % химически чистого карбида кальция, остальное составляют примеси — негашеная известь, углерод, кремнекислота и другое.
Применение при сварочных работах
Хранение карбида осуществляется в специальных стальных баках объемом 100 или 130 литров. Открытие этих баков должно производиться только при отсутствии огня или искр в близости от них деревянным молотком и латунным зубилом. Неиспользованный карбид в банке закрывается водонепроницаемой крышкой.
Ацетилен для сварочных работ вырабатывается из карбида в генераторе стационарного или мобильного типа и разного объема. Средний объем ацетиленовых генераторов рассчитан на прием от 5 до 15 литров воды и, соответственно, 2-5 килограммов карбида. Выход ацетилена считается несколько ниже теоретического и принимается равным 260-280 литров с одного килограмма CaC2. Рекомендуется использовать карбид крупной фракции – 80 мм
Принцип использования ацетилена для сварочной работы таков:
- Из одного килограмма карбида выделяется около 250 литров ацетилена, а на разложение килограмма карбида уходит 3-4 литра воды. Зная эти пропорции, вычисляют необходимый объем воды и количество вещества.
- В промышленных генераторах, рассчитанных на долгий и равномерный процесс использования, карбид дозировано загружается в газообразующую камеру через специальный бункер в автоматическом режиме. В генераторах, которые используются для ненормированных объемов работ, карбид погружается в воду в специальной корзине. Объем вырабатываемого ацетилена регулируется погружением или подъемом корзины.
- При подаче очередной порции карбида и начале реакции в камере возрастает давление, снижение которого производится активным выпуском ацетилена в горелку.
- Ацетилен через отборник по шлангу подается в газовую горелку. Горелка должна находиться от генератора на расстоянии не менее 10 метров.
- Гашеная известь, образующаяся в процессе реакции (около 1,2 кг на каждый килограмм карбида), удаляется из генератора через отдельный бункер.
В газовой сварке главным плюсом применения карбида является его низкий вес и небольшой вес применяемого оборудования. Газовые баллоны для ацетилена очень тяжелые, их необходимо перемещать на специальной тележке или в 2-3 пары рук. Средний же генератор весит 15-20 кг, что позволяет без особых усилий перемещать его в одиночку или с одним помощников. При перемещении сухого карбида достаточно соблюдать элементарные правила хранения – избегать попадания влаги на вещество и попадание мелкой карбидной пыли на кожу и в глаза.
Транспортировка и хранение
Порошок карбида кальция при воздействии влаги практически моментально разлагается. При этом образуется ацетилен, который при большой концентрации горюч и взрывоопасный. Именно поэтому нужно уделять довольно много внимания хранению карбида кальция, для чего часто применяют бидоны и специальные барабаны. К другим особенностям хранения отнесем следующие моменты:
- Выделяющийся ацетилен легче воздуха, поэтому скапливается вверху. Стоит учитывать, что он обладает наркотическими действиями, может самовоспламеняться.
- При производстве большого объема вещества особое внимание уделяется технике безопасности. Для фасовки применяются специальные упаковки.
- Для открытия упаковки следует использовать инструменты, которые не становятся причиной образования искр.
- Если вещество попадает на кожу или слизистую оболочку, то его нужно сразу удалить. При этом пострадавшая поверхность обрабатывается специальным кремом или другим защитно-заживляющим веществом.
- По установленным правилам, транспортировка может проводится исключительно при применении крытого транспортного средства. При этом проводить доставку по воздуху запрещается.
Контейнер для транспортировки
Установленные правила также запрещают хранить карбид кальция вместе с другими химическими веществами и источниками тепла. Это связано с тем, что образующиеся газы могут вступать в химическую реакцию с другими химическими веществами и возгораться.
В сокращении выбросов CO2
Остатки, полученные от получения ацетилена из CaC2 (также называемый «осадок карбида кальция» или «остатки карбида кальция») используются для получения клинкера или бетона.
Грязь из карбида кальция имеет высокое содержание гидроксида кальция (Ca (OH)2) (около 90%), немного карбоната кальция (CaCO3) и имеет pH более 12.
По этим причинам он может реагировать с SiO.2 или Al2ИЛИ3 образуя продукт, аналогичный продукту, полученному в процессе гидратации цемента.
Один из видов деятельности человека, который производит больше выбросов CO2 это строительная отрасль. Сотрудничество2 он образуется на востоке, чтобы отделиться от карбоната кальция во время реакции с образованием бетона.
Использование осадка карбида кальция для замены карбоната кальция (CaCO3) было обнаружено, что снижает выбросы CO2 на 39%.
Ссылки [ править ]
- https://materialsproject.org/materials/mp-1575/
- Массалимов, ИА; Киреева, М.С.; Сангалов, Ю. А. (2002). «Структура и свойства механоактивированного пероксида бария». Неорганические материалы
.
38
(4): 363. DOI : 10,1023 / A: 1015105922260 . S2CID 91881752 . - Информация о рейтинге опасности NFPA для обычных химических веществ . Северо-Восточный университет
- Patnaik, Pradyot (2003). Справочник неорганических химических соединений . Макгроу-Хилл. ISBN 0-07-049439-8.
- ↑
Винколи, Джеффри Уэйн (25 ноября 1996 г.). Управление рисками для опасных химических веществ . CRC Press. п. 429. ISBN. 978-1-56670-200-3. - ^ а б в г Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов
(2-е изд.). Баттерворт-Хайнеманн . п. 298. ISBN 978-0-08-037941-8. - Рассчитано на основе данных CRC Handbook of Chemistry and Physics
. - ^ a b Карбид кальция , Бернхард Лангхаммер, Энциклопедия промышленной химии Ульмана, Wiley Interscience. (Требуется подписка)
- Фриман, Гораций (1919). «Производство цианамида» . Химические новости и журнал физических наук
.
117
: 232. - Морхед, JT и де Chalmot, G. (1896). «Производство карбида кальция» . Журнал Американского химического общества
.
18
(4): 311–331. DOI : 10.1021 / ja02090a001 .CS1 maint: multiple names: authors list (link) - Муассан, Х. (1892). «Chimie Minérale — Description d’un nouveau four électrique» . Comptes rendus hebdomadaires des séances de l’Académie des Sciences
.
115
: 1031. - Ренуф, Эдвард (1899). «Использование ацетилена» . Ежемесячный научно-популярный журнал
: 335–347. - «Zgrada Prve hidrocentrale na Balkanu — Komisija za očuvanje nacionalnih spomenika» . old.kons.gov.ba
(на сербохорватском). КОНС . Проверено 15 марта 2022 . - ^ a b Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов
(2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8. - ↑
Дун, Я (23 января 2006 г.). «Неприятности в индустрии ПВХ» . Совет по развитию торговли Гонконга. Архивировано 28 декабря 2007 года.CS1 maint: bot: original URL status unknown (link) - «Правительство принимает меры по сдерживанию развития сектора карбида кальция» . China Daily через BusyTrade.com. 2007-05-16. Архивировано 11 февраля 2007 года.CS1 maint: bot: original URL status unknown (link)
- Лаксон, Джейми; Шлаг, Стефан; Токи, Горо (декабрь 2004 г.). «Карбид кальция» . НИИ Консалтинг.
- «Спелеологическое оборудование и культура (из Энциклопедии Те Ара Новой Зеландии)» .
- Клеммер, Грегг (1987). Карбидные лампы американских горняков: Руководство для коллекционеров по освещению американских карбидных рудников
. Публикации Westernlore. - Абелес, FB и Gahagan, HE III (1968). «Поглощение: роль этилена, аналогов этилена, двуокиси углерода и кислорода» . Plant Physiol.43
(8): 1255–1258. DOI : 10.1104 / pp.43.8.1255 . PMC 1087003 . PMID 16656908 . CS1 maint: multiple names: authors list (link) - «Ставка на это. Ваше манго созревает с использованием карбида» . ДНК
. 2013-05-18 . Проверено 25 августа 2022 . - «Употребление искусственно созревших фруктов вредно» .
- «Carbidschieten wordt feest» (на голландском). Algemeen Dagblad . 2016-12-24.
- Сингх, Рандхир. «Определение содержания воды в почве — метод карбида кальция» . Портал гражданского строительства
. Проверено 7 сентября 2022 . - ASTM International. «ASTM D4944-18, Стандартный метод испытаний для определения содержания воды (влаги) в почве в полевых условиях с помощью измерителя давления газа карбида кальция» . ASTM International . Проверено 7 сентября 2022 .
- дю Буа, TME «Molehill Mayhem» . п. 21.
- «Как избавиться от дворовых кротов с помощью карбида» . mysunnylawn.com
.
Что такое карбид?
Самодельные бомбы. Вот, что приходит на ум первым делом, когда слышим слово карбид. И нет, занимались производством этих опасных игрушек не предприятия оборонной промышленности, а, как правило, мальчишки, лет так десяти.
Лет двадцать назад это было излюбленное развлечение у подростков. Это сейчас все сидят за своими планшетами, а тогда миром правил пытливый ум ребенка, который норовил все испробовать на практике.
Для того, чтобы почувствовать себя Рембо, требовалось раздобыть один чудо-камешек. Находили их дети чаще всего на стройках. А дальше все было просто: пластиковый сосуд, камень, вода, плотно закрученный колпачок. Все это рьяно трясли, и в лучшем случае, отбрасывали куда подальше. А в худшем «снаряд» разрывало прямо в руках, тогда травм было не избежать.
Карбид кальция
Были и более безопасные пути использовать находку, к примеру, просто бросить в лужицу, тогда можно было наблюдать нечто похожее на действие современных бомбочек для ванны. Так что это за популярная «игрушка». Большинство из нас считали, что таким, как мы его знаем, карбид произвела природа. Но на самом деле это не так. И сегодня Вы в этом убедитесь.
Итак, вещество это всегда очень твердое, плюс ко всему, чтобы его расплавить, нужно приложить недюжинные усилия. На вид это темные, светлые, зеленоватые камни, либо порошок, все зависит от состава. Срок его годности недолог, как правило это полгода. Уложить емкости в общий склад не получится, у таких потенциально опасных веществ должен быть свой отсек.
Как Вы уже знаете, карбид постоянно норовит взорваться. Причем, некоторым соединениям даже особых условий не надо. Достаточно просто пересыпать порошок из тары в тару, как он может неожиданно рвануть.
Свойства и состав
Чтобы получить этот камень, нужно, как минимум, два элемента. Во-первых, это углерод. Его наличие обязательно. А дальше уже есть выбор: металл, или неметалл. Главное, чтобы выполнялось правило: электроотрицательность (сила, с которой атомы элемента притягивают к себе чужие электроны) обязательного компонента выше, чем его «партнера». Иначе получатся совсем другие соединения.
Формула карбида кальция
Впервые об этом соединении заговорили в Англии еще в 19-м веке. Однако, слава первооткрывателя досталась французу, благодаря опытам которого вещество официально признали, случилось это лишь к концу столетия. А теперь от том, какие качества присущи этому соединению:
- Материал необычайно твердый. По этому показателю он почти догнал алмаз. Среди рекордсменов – карбид вольфрама (9 из 10 возможных баллов). Это открывает сотни путей его применения.
- Чтобы расплавить камень, нужно будет приложить немало усилий. Ведь для этого необходимо нагреть его до 2-х, или даже 3-х тысяч градусов Цельсия. Эта цифра будет выше значений, необходимых для того, чтобы изменить состояние металлических веществ, до того, как они оказались в составе карбида.
- Это очень «не контактное» соединение. Так, реакция карбида на очень многие вещества будет нулевой. Для этого нужны особые условия. Потому кислоты, и прочие вещества, способствующие коррозии, им не страшны.
- Но предыдущий пункт не касается воды. Как Вы уже поняли из рассказа выше, карбид и вода – часто идут рука об руку. В случае, к примеру, когда задействован карбид кальция, для этого подойдет абсолютно любая влага, не нужно никаких условностей. Если же в работе карбид кремния, то без нагрева никак – нужен раскаленный пар (1800 градусов).
Виды
Науке известны три разновидности таких соединений:
- Ковалентные
Что их отличает, так это очень прочные связи между атомами. Когда упоминается такой тип, то речь лишь о двух элементах, соседствующих с углеродом: первый – это бром, второй – кремний. Все вышеперечисленные свойства в этих соединениях «выставлены» на максимум. Это и небывалая твердость, и стойкость. Захотите растворить – не получится без участия едких кислот огромной концентрации. Тоже самое касается и взаимодействия с кислородом. Просто так не получится, нужен нагрев, и не хилый – до 1000 градусов.
- Солеобразные, либо ионные
Здесь в контакт с углеродом вступает либо алюминий, или металл, но не абы какой, а только из 1-2 групп хим. таблицы. Придать такому соединению жидкую форму все еще не очень просто, нужен предельный нагрев. А вот кислота незамеченной не останется, в результате такой «встречи» карбид распадется.
- Металлоподобные
Получаются они из металлов, относящихся к 4-8 группе, сюда же идут кобальт, а также никель, ну и, конечно, железо. Если рассматривать их химическое строение, увидим, что атомы углерода буквально разбросаны, между ними нет связей, они словно вкрапления в образовавшихся в металле пробелах. Потому то они весьма тугоплавкие, можно даже сказать, чемпионы в этом деле. Это позволяет применять их при изготовлении сверл (победитовые сверла).
Применение
Как уже упоминалось, чаще всего это вещество можно встретить на стройке. И там ему находят десятки способов применения. В шлифовке без этого материала трудно обойтись, из него производят спец. диски. Но хорош он не только в качестве абразива, но и в виде острых режущих кругов, ножей и тому подобного.
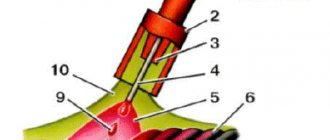
Генератор ацитиленовый для газосварки, внутрь которого засыпается карбид кальция
Машиностроение – еще одна возможность использовать это соединение. Из карбида получаются не только различные детали автомобилей, но и зап. части для радио приборов. А благодаря своей теплопроводности он отлично справится и с задачей нагревательного типа. Даже в ядерной промышленности без такого составляющего никак. Все это требует особой прочности, поэтому здесь речь чаще всего о ковалентных видах.
Те составы, что содержат карбид железа, позволяют получить сталь, и всем известный чугун. Кремниевые соединения так же ценят ювелиры и производители осветительных элементов. Искусственный каучук и смолы, и даже уксусная кислота – настолько широк круг применения карбидов.
Но этим дело не ограничивается. Этот искусственный минерал еще и для огородников важен. Ведь с его помощью получают особый вид удобрений. Они способны регулировать скорость роста различных культур.
Но, пожалуй, самый популярный из всех – карбид кальция. Ведь именно его в своей работе активно используют сварщики. Казалось бы, как этот темный камушек с чесночным ароматом может быть задействован в таком процессе?
Очень просто, ведь для газовой сварки, что логично, нужен горючий газ. В нашем случае дает карбид ацетилен. Как только он «встречается» с кислородом, мы получаем весьма интенсивное пламя, его температурные показатели переступают отметку в три тысячи градусов.
Если брать уже готовый летучий газ, то упаковкой ему служат спец. емкости, в них вещество доставляют к месту действия. Никакой тряски, или ударов во время такой поездки быть не должно – смертельно опасно.
Это сырье может вспыхнуть, даже без лишней «помощи», потому внимание всегда должно быть на пределе. Если же пожара избежать не удалось, никакой влаги при тушении. В ход должны идти только порошковые способы тушения.
Есть второй путь – произвести это «топливо» прямо на месте работ. Для этого нужно знать, что такое гидролиз карбидов. Говоря проще, это реакция соединения на контакт с водой. Причем, этот самую реакцию может вызвать даже одна капля.
Потому, если собрались осуществить сварочные работы, предельно аккуратно вскрываем герметичную тару с карбидом. Особо важно, чтобы никаких признаков огня по соседству, иначе ЧП гарантированно. О сигаретах и вовсе стоит забыть.
Еще следите за тем, чтобы даже самые мелкие крошки не оказались на Вашей коже, тем более на слизистых, иначе, в лучшем случае – раздражение, с худшем- ожоги и распухшие части тела. Так что вооружайтесь спец. обмундирование: защитить нужно все, с ног до головы, в том числе и дыхательные пути. Первая помощь, если контакта избежать не удалось: обильно поливаем водой пораженный участок, покрываем его плотным кремом. При необходимости вызвать врача.
Если говорить о расходе, если масса карбида один килограмм, то это дает возможность выработать до трехсот кубических дециметров газа. Это достаточно хорошие показатели. Так же на такое количество сырья потребуется примерно литров 20 воды, хотя производители и заявляют, что достаточно будет полулитра. То, сколько времени все это займет, зависит от величины фракций соединения, и их чистоты.
После того, как с работой закончили, оставшиеся отходы, а это шлак из извести, не оставляем где попало, а утилизируем. Для таких работ потребуется спец. генератор. Бывают они внушительных размеров, их устанавливают на одном месте, к примеру, когда планируются масштабные работы. Но существует и мини-версия, переносная.
Сначала отсек, в котором и должен образоваться газ, заливаем водой, потом уже добавляем туда карбид. Идет реакция, появившийся в результате ацетилен по мягкой трубке поступает непосредственно к газовой горелке. Этот путь должен быть достаточно длинным, шланг обязательно нужно выбрать не короче десяти метров.
Карбид бора
Идет в дело и карбид бора. Предметы на его основе дают надежную защиту от огня. И не только от огня, кстати, ведь такой товар активно используют изготовители бронежилетов. Во-первых, он «ловит» пули, а во-вторых, не даст прохода и радиации. Что касается такого союза, как карбид алюминия, то сверкающие искры во время фейерверков – его заслуга. А ведь на вид это ничем не примечательный желтый порошок.
Как получают карбид?
Сначала о карбиде кальция. Его производство – дело востребованное. И хотя такие заводы требуют больших трат, особенно когда речь заходит об электроэнергии, предприятия от привычного способа изготовления не отказываются. Потому как спрос на такую продукцию не спешит падать. Ведь без ацетилена вряд ли можно представить хоть одну стройку. Чтобы экономить на электричестве, подобные предприятия открывают в странах с большим количеством ГЭС, в Канаде, например.
Почему же не перейти на работу с метаном, ведь из него тоже можно получить такой летучий газ? Да потому, что карбид кальция дает практически чистый продукт, довести до ума 98-ми процентный газ несложно. И перевозить его гораздо проще, чем тот, что получен при участии метана.
Главным объектом на таких производствах выступают электрические печи. В них загружают твердый уголь, который еще зовут коксом, и оксид кальция (известь, причем абы какая не подойдет, нужна очищенная и однородная). Все это раскаляется до 2-х тысяч градусов. И вуаля, реакция пошла.
Как результат жидкая субстанция, которая и станет потом привычным нам соединением. Но сначала ей нужно охладится в формах. После того, как градус снижен, эти пласты дробят на более удобные в использовании куски.
Теперь о кремниевом варианте. Получили его абсолютно случайно, как это по обыкновению бывает. Американский ученый пытался создать искусственный алмаз. В результате экспериментов произошло получение карбидов кремния (они, кстати, на втором месте по твёрдости после не ограненного бриллианта).
Он его запатентовал и открыл первый завод по производству материала. Сказать, что технология с тех пор сильно изменилась – нельзя. Разве что из нее исключили песок и соль, остался углерод и кремнезём, которые все так же накаляют до максимальных температур в печах.
Внешние ссылки [ править ]
- Карбид кальция и ацетилен в Периодической таблице видео
(Ноттингемский университет) - Производство карбида кальция
- Паспорт безопасности материала на 2008 год
| vтеСоединения кальция | |
| |
| Авторитетный контроль |
|
Прекращенное использование
ЦК2 он использовался в так называемых карбидных лампах. Их действие заключается в капании воды на карбид кальция с образованием ацетилена, который воспламеняется и, таким образом, дает свет.
Эти лампы использовались на угольных шахтах, но их использование было прекращено из-за наличия метана CH4 в тех шахтах. Этот газ легко воспламеняется, и пламя карбидной лампы может воспламениться или взорваться.
Они широко использовались в сланцевых, медных и оловянных рудниках, а также в ранних автомобилях, мотоциклах и велосипедах в качестве фар или фар.
В настоящее время их заменяют электрические лампы или даже светодиодные лампы. Однако они по-прежнему используются в таких странах, как Боливия, на серебряных рудниках Потоси.