Карбид кальция: применение и меры безопасности
Определение
– химические соединения которые получаеются в результате щелочных реакций углерода с металлами. В большинстве случаев получаются сверхтвердые сплавы, сравнимые по своим твердостным характеристикам с алмазом.
Наиболее широкую известность и распространение получил сплав, называемый карбид кальция — химическая формула соединения CaC2
Сейчас небольшой экскурс в историю возникновения этого химического соединения.
Коротко об истории
Томас Уилсон и Фердинанд Муассан, действуя обособленно, практически единовременно разработали способ выпуска карбида кальция в электрической плавильной печи. Это открытие стало толчком для запуска индустрии получения технического карбида кальция.
Технология
В производстве карбида кальция участвуют два элемента: оксид кальция (CaO) известный также как негашеная известь и углеродные соединения в виде кокса (антрацита, каменного угля):
CaO + 3C = CaC2 +CO Оба компонента подвергаются измельчению и последующему обжигу и расплавлению посредством электродугового способа.
Готовый раствор доходит до твердого состояния в специальных формах, а впоследствии подвергается дроблению и сортировке.
Зависимость удельного веса технического карбида кальция от содержания CaC2
| Содержание СаС2 в техническом карбиде, % | 78 | 74 | 69 | 63 | 60 | 56 |
| Н/м³(Удельный вес) технического карбида | 2,3 | 2,35 | 2,4 | 2,43 | 2,48 | 2,5/td> |
Состав CaC2 (технического) используемого для сварочных работ
| Элемент | Процентное содержание от массы |
| Карбид кальция | 72 |
| Известь | 17 |
| Углерод | 1 |
| Окись магния | 0,3 |
| Сера | 0,3 |
| Железо и аллюминий | 2,6 |
| Кремний | 2 |
| Другие компоненты | 4 |
Минимальный температурный порог образования карбида кальция 1619°С. Как правило, процесс производства ведется при 1900-1950°С. Температурный рост приведет к распаду карбида кальция на металл и углерод.
При наличии небольшой электродуговой печи и источника тока можно воспроизвести процесс образования карбида кальция:
- Берем графитовый тигель или угольный электрод (перед этим сделав в нем углубление) ⇒ помещаем негашеную известь и равные по массе куски кокса
- Подводим электрод к смеси создавая электрическую дугу. Уголь хорошо проводит ток в смеси ⇒ ждем примерно полчаса пока дуга будет гореть
- После остывания смесь превращается в сплав, который, если опыт прошел успешно, содержит маленькие кусочки карбида. Чтобы проверить это, полученную массу поместим в воду и соберем образующиеся пузырьки газа в пробирке, перевернутой вверх дном и заполненной водой.
Можно выделить ряд факторов, влияющих на быстроту формирования и качественные характеристики конечного продукта:
- размер, плотность, наличие примесей в первоначальном сырье
- физические и технические параметры печи
- соблюдение этапов технологического процесса
Несмотря на модернизацию промышленных процессов, производство карбида кальция остается трудозатратным, требующим больших площадей и финансовых вложений.
Особенности
Карбид кальция — прочный элемент с кристаллической структурой. От качества исходного сырья зависит конечный тон: может варьироваться от голубоватого до фиолетового, черного. А также возможно присутствие неприятного запаха с нотками чеснока. Процесс слияния с водой, растворами минеральных кислот, щелочей протекает с выделением большого количества тепла, имеет производственную важность.
CaC2 + 2H2O => Ca(OH)2 + C2H2 — . В результате этой реакции также образуется ацетилен — ненасыщенный углеводород с тройной связью.
С кислородом реакция разложения карбида кальция идет только под воздействием повышенных температур (700 — 900 °C): 2CaC2 + 5O2 → 2CaO + 4CO2 —
Складирование и перевозка
Карбид кальция нужно фасовать во влагозащищенных емкостях, резервуарах, чтобы исключить доступ влаги и не допустить процесса распада. Процедуре расфасовки и распаковки стоит уделить особое внимание
- проявить аккуратность, не использовать инструмент, образующий искры при работе.
- необходимо обеспечить участников процесса средствами защиты, так как попадание карбида в организм и на кожу человека является опасным.
- перевозка производится только транспортными средствами с закрытым кузовом. Аэродоставка запрещена.
- нужно обеспечить производственное помещение вентиляционной системой и не допускать совместного хранения с прочими товарами.
Полезные стороны
Карбид кальция — стартовый элемент для производства многих соединений.
Агрегация карбида кальция и азота используется в получении цианамида кальция.
Он относится к нитратным стимуляторам, активно используемым в агрономии. Эта соль становится исходным компонентом при синтезе мочевины, гуанидина.
В металлургии служит для раскисления металлов и десульфурации (понижение содержания кислорода и серы соответственно).
А какую забаву вызывало у детей похитить со стройки камушек карбида и бросать в лужи, любуясь шипением и бурлением. А особо смелые подносили спичку к исходившему газу, и загоралось голубое пламя.
Полезный газ
Изначально карбид кальция применялся исключительно для получения ацетилена. Это органическое соединение использовали для создания карбидных ламп, применяемых для освещения улиц. Такие источники света используют и сегодня в спелеологии, как походное снаряжение, на маяках.
Ацетилен – полупрозрачный, водорастворимый газ используется для получения таких органических соединений, как хлорэтан, поливинилхлорид, стирол.
Существует ряд синтетических продуктов, производных ацетилена. Например, комбинации с хлором дают продукты, превосходно растворяющие органические соединения, а также неорганические: серу, фосфор. Поскольку такие продукты являются негорючими, они успешно используются при вытяжке жиров. Ацетилениды кальция (соли ацетилена) с ионами серебра, меди и ртути используются в создании взрывчатых веществ. Особенно сильной разрушающей взрывной силой обладает соединение с золотом.
В функционировании реактивных двигателей участвует коктейль ацетилена и аммиака.
Ацетилен в соединении с H2O образует ацетальдегид, из которого изготавливается синтетическая уксусная кислота, ацетон, искусственные смолы и этиловый или водочный спирт
C2H2 + H2O → СH3-CHO
Всем известные клей ПВА, грампластинки, рекламные баннеры также являются производными этого газа.
Техника безопасности
Как уже отмечалось ранее, карбид кальций – это взрывоопасное вещество и для соблюдения безопасности в работе с ним нужно следовать нескольким обязательным условиям:
- создать герметичное место хранения и обработки;
- не допускать доступа источника огня;
- мелкие частички (карбидная пыль) вызывают раздражения кожных покровов, органов дыхания, поэтому обязательна защитная одежда, респираторы;
- генераторы ацетилена должны размещаться в строго изолированных местах;
- по завершении сварочных работ обязательно нужно утилизировать неотработанные шлаки в специальных местах;
- при транспортировке и хранении нужно исключить возможность столкновения баллонов, емкостей, так как это несет смертельную опасность.
– источник производства многих органических и неорганических соединений, которые широко используются в разных сферах жизни человека. Многие из них не имеют аналогов. Но, наряду с неисчерпаемой пользой этого вещества, не стоит забывать и о вреде, который он может нанести человечеству и экологии, ведь он относится к первому классу опасности, обладает взрыво и пожароопасными действиями.
Источник
КАРБИДЫ
КАРБИДЫ
(от латинского carbo – уголь) – соединения углерода с металлами, а также с бором и кремнием. Эти соединения обладают удивительным разнообразием физических и химических свойств. Так, карбид золота Au2C2 взрывается уже при попытке пересыпать его с листочка фильтровальной бумаги, на котором он был высушен. С другой стороны, карбиды некоторых элементов (например, бора и тантала) не разлагаются даже при температуре белого каления и настолько химически инертны, что на них не действует царская водка, а по твердости они приближаются к алмазу!
Также по теме:
ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ
Впервые необычное соединение металла с углеродом (К2С2) получил в 1809 знаменитый английский химик Гемфри Дэви. В 1863 французский химик Марселен Бертло изучил свойства другого карбида – очень неустойчивого и легко взрывающегося карбида одновалентной меди Cu2C2. В 1878 немецкий металлург Ф.Мюллер, растворив образцы стали в разбавленной серной кислоте, выделил карбид железа Fe3C. Но только в конце 19 в. французский химик Анри Муассан, прославившийся получением фтора, синтезировал многие из этих необычных соединений и изучил их свойства. Он получал карбиды, нагревая до очень высокой температуры смеси древесного угля с разными металлами, их оксидами или карбонатами. Для этого он использовал жар вольтовой дуги в электрической печи собственной конструкции.
Карбиды, как оказалось, можно получить не только в лаборатории. Еще до работ Муассана австрийский ученый Э.Вайнсхенк в 1889 открыл в метеоритах минерал когенит, представляющий собой смешанный карбид железа, кобальта и никеля состава (FeNiCo)3C. А сам Муассан в 1904 обнаружил в метеорите, привезенном из каньона Диабло в штате Аризона, темно-зеленый минерал, представляющий собой карбид кремния SiC. Этот минерал в честь ученого назвали муассанитом.
Также по теме:
УГЛЕРОД
Раньше карбиды классифицировали по их устойчивости к действию воды и кислот, а также по тому, какие газы выделяются при их разложении. Современная классификация учитывает тип химической связи между атомами в карбидах – именно от этого зависят в основном физические и химические свойства. В соответствии с этой классификацией, карбиды можно разделить на три группы, которые довольно сильно отличаются по своим свойствам.
К первой группе относятся так называемые солеобразные карбиды с ионной связью. Эти карбиды образуют щелочные и щелочноземельные металлы, алюминий, редкоземельные элементы, а также актиноиды. Их состав иногда соответствует типичным валентностям металлов (Al4C3), а иногда – нет (Ве2С). Многие ионные карбиды можно получить непосредственно из элементов (Са + 2С ® СаС2) или восстановлением оксидов углеродом (СаО + 3С ® СаС2 + СО). Ионный характер связи приводит к высокой температуре плавления; например, карбид кальция СаС2 плавится при 2300°С, карбид тория ThC2 – при 2655°С. Водой или разбавленными кислотами ионные карбиды легко разлагаются – гидролизуются. При этом образуются различные углеводороды и гидроксид металла. Самый известный пример – получение ацетилена гидролизом карбида кальция: СаС2 + 2Н2О ® Ca(OH)2 + С2Н2. Ацетилен выделяется также при гидролизе Na2C2, К2С2 и др. Поэтому такие карбиды можно рассматривать как производные ацетилена, в которых атомы водорода замещены атомами металла. При этом катионы металла и анионы С2–2 размещаются в соответствующих узлах кристаллической решетки. Солеобразный характер этих карбидов подтверждается возможностью их электролиза в расплавленном состоянии. Интересно отметить, что чистый карбид кальция – бесцветные кристаллы, хотя увидеть их непросто, так как обычный технический продукт имеет цвет от бурого до черного.
Взаимодействие карбидов щелочных металлов с водой протекает исключительно бурно. Так, если карбид калия просто облить водой, произойдет бурная реакция, которая сопровождается взрывом такой силы, что выделяющийся ацетилен сразу же разлагается с выделением угля. Чтобы провести реакцию К2С2 + 2Н2О ® 2КОН + С2Н2, надо медленно пропускать над карбидом водяной пар.
В ряде случаев карбиды ионного типа образуются непосредственно при пропускании ацетилена через растворы солей металлов. Так карбиды серебра, меди(I), золота и ртути, которые чаще называют ацетиленидами. Ацетилениды щелочных металлов можно получить действием ацетилена на свободные металлы. В сухом виде ацетилениды тяжелых металлов легко разлагаются со взрывом. Гидролиз ионных карбидов других металлов показывает, что они «происходят» из других углеводородов. Например, при гидролизе карбида алюминия выделяется метан: Al4C3 + 12H2O ® 4Al(OH)3 + 3CH4 (так же гидролизуется карбид бериллия Ве2С), а при гидролизе карбида магния получается метилацетилен: Mg2C3 + 4H2O ® 2Mg(OH)2+ НС≡С–СН3. Интересно, что карбид магния другого состава, MgC2, дает при гидролизе только ацетилен. Иногда при гидролизе ионных карбидов углеводороды выделяются совместно с водородом, который частично гидрирует непредельные углеводороды. С выделением почти равных количеств водорода и метана разлагается карбид марганца: Mn3C + 6H2O ® 3Mn(OH)2 + CH4 + H2. Карбиды редкоземельных металлов и тория при разложении разбавленными кислотами выделяют не чистый ацетилен, а его смесь с метаном, этиленом и другими углеводородами. Например, при гидролизе карбида церия СеС2 получается смесь ацетилена с метаном в соотношении 4:1, а также немного этилена и жидких и твердых углеводородов (состав продуктов зависит от условий проведения реакции). Еще больше жидких и твердых углеводородов дает при гидролизе карбид урана.
Выделение углеводородов при гидролизе карбидов позволило Д.И.Менделееву выдвинуть так называемую карбидную теорию происхождения нефти в глубинах Земли из неорганических веществ. По представлению Менделеева, в глубинах земного шара должны быть расплавленные металлы, в основном железо, которое с углеродом дает карбид. Во время горообразования в земной коре образуются трещины, по которым в глубины проникает вода. Воздействуя на карбид железа и карбиды других металлов, вода (в виде пара) образует углеводороды, например: 2FeC + 3H2O ® Fe2O3 + C2H4. Газообразные углеводороды по тем же трещинам поднимаются ближе к поверхности, где скапливаются в пористых пластах. Однако когда в 60-е гг. 20 в. был подробно изучен состав углеводородов нефти, оказалось, что смесь «искусственных углеводородов», образующихся при гидролизе карбидов, по своему составу резко отличается от природной смеси. Кроме того, все нефти, полученные неорганическим путем, оптически неактивны, тогда как природная нефть оптически активна. На основании этих, а также ряда других фактов неорганическая теория происхождения нефти была подвергнута критике, и в настоящее время многие ученые полагают, что нефть имеет биологическое происхождение.
Ко второй группе относятся карбиды, которые образуют переходные металлы IV–VII групп, а также кобальт, железо и никель. Это металлоподобные соединения с другой структурой. В них атомы углерода, имеющие небольшие размеры, не связаны друг с другом и располагаются в пустотах между атомами металлов. Различная упаковка атомов металла в кристаллической решетке приводит к разному составу карбидов даже для одного и того же металла; например, хром образует карбиды состава Cr3C2, Cr4C, Cr7C3 и др. Эти карбиды (их называют карбидами внедрения) часто отличаются большой твердостью и очень высокими температурами плавления. Например, карбиды тантала и гафния TaC и HfC – наиболее тугоплавкие из известных веществ (плавятся при 3985 и 3890°С соответственно).
Металлоподобные карбиды обладают высокой электропроводностью и очень высокой химической стойкостью к агрессивным средам (многие из них не растворяются даже в царской водке). Они используются для упрочнения чугуна и стали (карбиды железа, хрома, вольфрама, молибдена), а также для производства очень твердых сплавов, которые применяют для обработки металлов резанием (карбиды WC, TiC, TaC, VC, Cr3C2). Например, твердые наконечники резцов, сверл делают из победита – спеченного порошка карбида вольфрама WC с добавкой металлического кобальта. Очень важную роль играет карбид железа Fe3C (цементит) – твердые кристаллы, входящие в структуру чугуна и стали.
Карбид вольфрама WC используют также для изготовления буровых коронок, деталей аппаратуры для производства синтетических алмазов, для нанесения износостойких покрытий на поверхности металлов. Карбид титана интересен ярким проявлением нестехиометрии: состав этого соединения выражается формулой TiCх
, где
х
колеблется в пределах от 0,49 до 1 (
см
. СТЕХИОМЕТРИЯ). Это вещество, как и карбид вольфрама, используют как компонент жаропрочных, жаростойких и твердых сплавов, для получения износостойких покрытий, для изготовления тугоплавких тиглей, в которых можно плавить почти любые металлы (сам карбид плавится при 3257°С). Карбидом титана выкладывают внутренние стенки высокотемпературных печей.
К третьей группе относятся ковалентные карбиды. Их образуют кремний и бор – соседи углерода по периодической таблице, близкие к нему как по размеру атомов, так и по электроотрицательности. Карбид кремния SiC (техническое название – карборунд) в чистом виде – бесцветные кристаллы, но примеси часто окрашивают его в различные цвета, вплоть до черного. По своей структуре это соединение аналогично алмазу; решетку карбида кремния можно получить, если в немного расширенной решетке алмаза заменить половину атомов углерода на атомы кремния. Это вещество обладает очень высокой твердостью; помимо этого оно имеет свойства полупроводника. Из него делают шлифовальные бруски и круги, огнеупорные материалы для печей и литейных машин, нагревательные элементы для электропечей, полупроводниковые диоды.
Бор образует по два карбида с точно известной структурой – В4С и В13С2. Наибольшее значение имеет первый из них – черные блестящие кристаллы, которые по твердости уступают лишь алмазу и нитриду бора BN. Этот карбид применяют для изготовления абразивных и шлифовальных материалов и в качестве полупроводника. Карбид, обогащенный изотопом 10В, используется как поглотитель нейтронов в ядерных реакторах.
Илья Леенсон
Карбид кальция
При щелочной реакции углерода с металлами могут получится различные карбиды. За счет соединения определенных химических элементов получаются соединения, которые характеризуются высокой прочностью. Довольно большое распространение получил вариант исполнения, который получил название карбид кальция. Его стали применять в самых различных областях промышленности.
Внешний вид и характеристики технического карбида кальция
Впервые рассматриваемый состав был получен в 1862 году. Проводимая процедура касалась отделения кальция от извести, в результате чего получился бледно-серый состав без признаков, свойственных металлам. В результате опыта был получен карбид, который в последствии стал активно использоваться при выпуске различной продукции.
В начале 20 века карбид кальция стали использовать для производства ацетилена в больших объемах. Именно поэтому стали вести активные исследования для выявления более производительной технологии.
Технические характеристики материала определяют его широкое распространение. Внешний вид вещества характеризуется светло-серым цветом, выпускаются карбиды в виде камня или порошка.
Физические свойства
При выборе практически любого материала следует уделять больше всего внимания физическим свойствам. У рассматриваемого они следующие:
- Соединение имеет кристаллическую структуру.
- Показатель температуры плавления составляет 2300 °С. Стоит учитывать, что подобная цифра свойственна только чистому составу. Добавление в состав различных примесей приводит к тому, что температура плавления существенно падает.
Чистый карбид кальция
Стоит учитывать, что карбид кальция в большинстве случаев находится в твердом состоянии. Кроме этого, цвет может варьироваться от серого до коричневого цвета. Физические свойства карбида кальция определяют его широкое применение в самых различных отраслях промышленности.
Как выглядит карбид?
Чтобы определить, где найти карбид на улице, нужно знать его физические свойства. Физически вещество является твердым, его цвет может быть темным, имея сероватый или коричневый оттенок. Цвет зависит от количества углерода. Также имеется специфический запах, который характеризует данное вещество.
По консистенции он твердый, но легко крошится, превращаясь в порошок. Если поднести спичку, то начнется горение с выделением углерода и разложением кальция. Правда, этого можно достичь при высоких температурах, например охотничьей спичкой.
Химические свойства
Немаловажное значение имеют и химические свойства. Они также учитываются при применении материала. К основным характеристикам можно отнести следующие качества:
- Карбид кальция характеризуется тем, что хорошо впитывает влагу. Стоит учитывать, подобная процедура проявляется яркой химической реакцией, связанной с разложением вещества.
- При работе с рассматриваемым материалом стоит учитывать, что образующаяся пыль оказывает раздражительный эффект на слизистые органы. Кроме этого, подобная реакция может проявится при попадании кристаллов или пыли на поверхность кожи. Именно поэтому при работе с рассматриваемым соединением следует использовать респиратор и некоторые другие средства защиты.
- Кристаллы активное реагируют на воздействие других веществ зачастую только при нагреве. При этом может образоваться карбонат кальция.
- В некоторых случаях проводится соединение кристаллического вещества с азотом, в результате чего получается цианамид кальция.
- При нагреве может проходить реакция с мышьяком и хлором, а также фосфором.
Считается, что наиболее важным химическим качеством является податливость к разложению при воздействии воды.
Меры предосторожности
CaC 2 — нестабильное соединение, которое склонно взрываться. Дело в том, что кальций может вступить даже в реакцию с воздухом, а в результате реакции образуются летучие газы. Малейшая искра способна вызвать моментальное возгорание с выделением огромного количества тепла и метана, что повлечет за собой печальные последствия. Поэтому транспортировать вещество необходимо в герметичных контейнерах.
Американское химическое общество Национальные исторические химические памятники. Карбид кальция представляет собой химическое соединение с многочисленными промышленными применениями. В сочетании с водой он производит газ ацетилена, который используется в сварке и резаках. Согласно Гонконгскому совету развития торговли, карбид кальция также является ключевым компонентом большинства поливинилхлоридов, производимых в Китае. Агентство по охране окружающей среды обнаружило, что твердые частицы и другие побочные продукты попадают в окружающую среду в результате производства карбида кальция, но выбросы углеводородов в результате производства карбида кальция минимальны.
Любителям лайвхаков и «острых экспериментов» с карбидом стоит позаботиться о собственной безопасности. При работе с веществом следует надеть специальные перчатки, если взять карбид голыми руками, то их будет невозможно помыть. Реакция с водой вызывает не только выброс метана и теплоты, поэтому ожог кожи будет обеспечен.
Получение
Как ранее было отмечено, карбид кальция активно применяется при получении самых различных материалов. Именно поэтому процесс получения карбида кальция постоянно совершенствовался. К особенностям применяемых технологий можно отнести нижеприведенные моменты:
- В качестве сырья применяется негашеная известь. В большинстве случаев вещество получается из извести, но в домашних условиях провести подобную процедуру сложно.
- Известь смешивается с измельченном коксом для получения однородной массы.
- В промышленности карбид кальция получают по схеме, которая предусматривает нагрев вещества до высокой температуры. Для этого применяются электронные печи. Рекомендуемая температура плавления составляет 1900 ⁰С.
- После нагрева вещества до столь высокой температуры оно переходит в жидкое состояние. Для работы подготавливаются специальные формы.
При рассмотрении того, как из углерода получить карбид кальция отметим, что по установленным стандартам в состав должно входить не менее 80% основного вещества. На долю примесей должно приходится не более 25%, в число которых также входит углерод. Производство оксида кальция также приводит к выделению тепловой энергии, что стоит учитывать.
Где можно найти карбид
Раньше мальчишки крали со стройки карбид кальция и делали quot;бомбочкиquot;, которые работали по реакции: СаС2 + Н2О = С2Н2 + Са(ОН)2. То есть ребятки в бутылку с водой прибавляли карбид кальция, закрывали бутылку, пока она не заполнится ацетиленом, а потом поджигали и, смешиваясь с кислородом воздуха, эта смесь взрывалась, но иногда могла бутылка разорваться, тогда возможны большие неприятности с глазами, лицом и др частями тела. Но сейчас этот источник добычи карбида кальция закрыт, т.к. ацетилен продают в баллонах, с которым нужно обращаться с большой осторожностью, а карбид может быть возможно купить в магазинах химических реактивов (при предъявлении паспорта), если они не прекратили сво существование. Вам ,наверное, карбид понадобился для этих же целей? Будьте осторожны!
Для того чтобы достать карбид, нужно иметь представление о том, где же он используется. Так вот карбид активно используется в процессе сварки, поэтому достать карбид можно у сварщиков или же в тех местах, где идут обширные сварочные работы, возможно, там где идт прокладка газопровода и соответственно сварка труб.
А вот приобрести карбид можно попробовать в строительных магазинах или же в магазинах, реализующих разного рода химикаты. При этом при покупке обязателен паспорт.
Меню навигации
Пользовательские ссылки
Информация о пользователе
Сообщений 1 страница 13 из 13
Поделиться12009-09-22 14:46:49
- Автор: ghhjd
- Members
- Зарегистрирован: 2009-09-22
- Приглашений: 0
- Сообщений: 5
- Уважение: [+0/-0]
- Позитив: [+0/-0]
- Провел на форуме: Не определено
- Последний визит: 2009-10-23 14:51:30
Собственно, где можно достать карбид кальция? Я слышал у сантехников, но у меня знакомых нету. А покупать я везде его вижу в бочках 125кг… А мне надо то, совсем немного.
Поделиться22009-09-22 17:23:19
- Автор: MRACOBESSS
- Зам. Администратора
- Откуда: Россия-Мать
- Зарегистрирован: 2009-01-12
- Приглашений: 0
- Сообщений: 3501
- Уважение: [+0/-0]
- Позитив: [+0/-0]
- Возраст: 41 [1978-07-02]
- ICQ: 569541908
- Провел на форуме: Не определено
- Последний визит: 2014-06-25 09:25:25
в бочках никогда не видел , есть конечно, но для рядового розничного покупателя как раз доступны только пачки по 3 -5-10 кг. магазины для сварки посещай.
Поделиться32009-09-22 17:30:05
- Автор: Ox />
- Зарегистрирован: 2008-05-15
- Приглашений: 0
- Сообщений: 1002
- Уважение: [+0/-0]
- Позитив: [+0/-0]
- Провел на форуме: Не определено
- Последний визит: 2013-09-15 17:50:58
Собственно, где можно достать карбид кальция? Я слышал у сантехников, но у меня знакомых нету. А покупать я везде его вижу в бочках 125кг… А мне надо то, совсем немного.
У сантехников?! Чтоб в унитазы бросать. lol*) lol*) lol*) У сварщиков, ты видимо не расслышал.
Поделиться42009-09-22 20:12:13
- Автор: DNK
- Заблокирован
- Зарегистрирован: 2009-02-04
- Приглашений: 0
- Сообщений: 2356
- Уважение: [+0/-0]
- Позитив: [+0/-0]
- Возраст: 10 [2009-01-31]
- Провел на форуме: Не определено
- Последний визит: 2013-03-15 09:58:08
Собственно, где можно достать карбид кальция? Я слышал у сантехников, но у меня знакомых нету. А покупать я везде его вижу в бочках 125кг… А мне надо то, совсем немного.
Приезжай к нам в деревню, кривой тебе даст хоть множко, хоть немножко за 1 бутыль с ц2аш5ош в смеси с аш2о
Поделиться52009-09-22 20:26:35
- Автор: пиротехник-любитель
- Гость
Я конечно понимаю что карбид кальция – слабочувствительное взрывчатое соединение, но каким боком оно тут? вы смеси на нём делаете? В химреактивах теме скорее место.
Поделиться62009-09-22 21:17:55
- Автор: DNK
- Заблокирован
- Зарегистрирован: 2009-02-04
- Приглашений: 0
- Сообщений: 2356
- Уважение: [+0/-0]
- Позитив: [+0/-0]
- Возраст: 10 [2009-01-31]
- Провел на форуме: Не определено
- Последний визит: 2013-03-15 09:58:08
Я конечно понимаю что карбид кальция – слабочувствительное взрывчатое соединение, но каким боком оно тут?
ЭЭЭЭЭ либо у меня башню снесло, либо у тебя – кода это ацетиленид кальция стал взрывчтаым соединением? ацетилен – да, но карбид. И вообще, в мусор тему, такая уже есть в реактивах
Транспортировка и хранение
Порошок карбида кальция при воздействии влаги практически моментально разлагается. При этом образуется ацетилен, который при большой концентрации горюч и взрывоопасный. Именно поэтому нужно уделять довольно много внимания хранению карбида кальция, для чего часто применяют бидоны и специальные барабаны. К другим особенностям хранения отнесем следующие моменты:
- Выделяющийся ацетилен легче воздуха, поэтому скапливается вверху. Стоит учитывать, что он обладает наркотическими действиями, может самовоспламеняться.
- При производстве большого объема вещества особое внимание уделяется технике безопасности. Для фасовки применяются специальные упаковки.
- Для открытия упаковки следует использовать инструменты, которые не становятся причиной образования искр.
- Если вещество попадает на кожу или слизистую оболочку, то его нужно сразу удалить. При этом пострадавшая поверхность обрабатывается специальным кремом или другим защитно-заживляющим веществом.
- По установленным правилам, транспортировка может проводится исключительно при применении крытого транспортного средства. При этом проводить доставку по воздуху запрещается.
Контейнер для транспортировки
Установленные правила также запрещают хранить карбид кальция вместе с другими химическими веществами и источниками тепла. Это связано с тем, что образующиеся газы могут вступать в химическую реакцию с другими химическими веществами и возгораться.
Где можно достать карбид
Карбид-это химическое вешество.Их бывает несколько видов на этом сайте вы узнаете что это такое,где его взять, и где можно использовать. Начнем с того что карбид это дымовая шашка, его обычно используют футбольные фанаты, или чтобы выгнать грызунов из норы и т.п. Собственно некоторых людей мучает вопрос где его взять этот так называемый карбид,его используют сварщики но врядли они вам его дадут! Так вот врядли вы замечали когда входите в старую электричку пригородных поездов что прямо над вашей головой и находится карбид, находится он у тамбурных дверей на потолке но если же там прикручена картонка или кусок пластмассы то увы его там нету. Также его можно дастать в экспрессах, он находится под сиденьями в белых железных каробках, чтобы его выкрутить вам понадобятся инструменты (гаичный ключ,пласкогубцы, отвертка плоская, и молоток). В электричке он там для того чтобы при пожаре карбид дымит и вытягивает воздух и огонь тухнет. Также на нашем сайте вы увидете фото подробно показано где расположен карбид и как его достать а также наших друзей которые покоряют разные депо в поисках карбида (Смотрите их в галерее).
Применение карбида кальция
Как ранее было отмечено, карбид кальция встречается в самых различных областях промышленности, зачастую поставляют для проведения промышленного синтеза. Свойства карбида кальция и реакция, протекающая при его соединении с различными веществами, определяют использование вещества в нижеприведенных случаях:
- Многие синтетически компоненты, входящих в состав современных материалов, производят на основе рассматриваемого компонента.
- Применяется для получения цианамида кальция. Подобный компонент используется для получения различных химических удобрений. Именно поэтому сырье применяется для регулирования скорости роста растений.
- Цианамид кальция также получают при соединении вещества с азотом.
- В некоторых случаях проводится восстановление металлов щелочной группы.
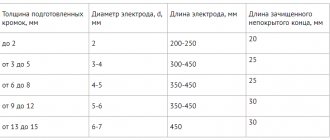
- Можно использовать рассматриваемое соединение в процессе газовой сварки.
При рассмотрении карбида кальция и области применения стоит учитывать, что подобное вещество чаще всего применяют для получения ацетилена. Подобный синтез карбида кальция разработал немецкий ученый. Среди особенностей подобного способа применения отметим следующие моменты:
- Ацетилен из карбида получают при оказании воздействия водой на используемое сырье.
- В результате прохождения химической реакции образуется требующийся газ, гашеная известь выпадает в осадок.
- Стоит учитывать, что при смешивании компонентов выделяется большое количество тепла. Поэтому работа должна проводится с учетом техники безопасности.
- В зависимости от вида применяемой технологии переработки сырья с 1 килограмма выходит около 290 литров газа.
- Скорость протекания процедуры зависит от чистоты применяемого сырья, температуры и количества воды.
Получение ацетилена из карбида кальция
Как показывает практика, при использовании чистого карбида на протекание химической реакции отводится около 20 литров волы на 1 килограмм сырья. Подобное количество воды требуется для того чтобы снизить температуру реакции, за счет чего обеспечиваются оптимальные условия для работы.
Качественная реакция
Мало знаний о том, где найти карбид, необходимо удостовериться в подлинности вещества. Для качественной реакции понадобится всего лишь немного воды (на улице можно воспользоваться даже собственной слюной). При взаимодействии CaC2 происходит выделение метана и гидроксида кальция. Можно наблюдать характерное шипение, а если поднести в этот момент спичку — воспламенение.
Из-за бурной реакции с водой карбид разлагается от атмосферной влаги. Поэтому вопрос о том, где найти карбид кальция на улице, весьма спорный. Известно, что в чистом виде его не существует, данное соединение является в большей части искусственным, нежели природным.
Техника безопасности
При проведении различных химических реакций для производства материалов должна соблюдаться техника безопасности. Как ранее было отмечено, выделяемые вещества могут быть взрывоопасными. Техника безопасности при взаимодействии с различными химическими веществами заключается в следующем:
- Для хранения и обработки требуется герметичное место. В обычном гараже проводить работы не рекомендуется.
- Нельзя допускать огонь к самому сырью, а также образующимся газам.
- Даже мелкие частицы могут привести к поражению кожных покровов. Именно поэтому работа должна проводится в респираторе и защитной одежде.
- Генераторы ацетилена размещают исключительно в хорошо изолированных помещениях.
- Если сырье применялось при проведении сварочных работ, то следует образующийся шлак утилизировать в специальных местах.
- При перемещении металлических и иных емкостей они должны быть надежно закреплены, столкновение и падение не допускается. Это может привести к появлению искр, которые станут причиной взрыва вещества.
Горение карбида кальция
Вышеприведенная информация определяет то, что работы с рассматриваемым сырьем не рекомендуется проводить в гараже или домашней мастерской. Несоблюдении технологии, отсутствии требующего оснащения и многие другие причины могут привести к возникновению искры и воспламенению веществ.