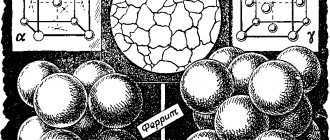
Ярким примером аллотропии является железо, образующее в зависимости от температуры четыре основных аллотропических видоизменения, которые называют: α-Fе, β-Fe, γ-Fe, δ-Fe.
Аллотропические формы α-Fe — альфа железо, β-Fe — бета железо и δ-Fe — сигма железо имеют кристаллическую решетку в форме центрированного куба ( рис. 1, а). Аллотропическая форма γ-Fe — гамма железо имеет кристаллическую решетку в форме куба с центрированными гранями (рис. 1, б).
Переход железа из одной формы в другую — при охлаждении происходит с выделением тепла, а при нагревании — с поглощением тепла. Это отмечается на графиках охлаждения или нагревания железа На рис. 2 дан схематический график охлаждения чистого железа.
Фото кристаллических решеток железа
Кристаллическая решетка — это пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Ha этой кривой при переходах одной аллотропической формы в другую наблюдаются площадки постоянных температур, а именно: при t=1535°— затвердевание железа с образованием δ-Fe;
фото кристаллических решеток железа
при t= 1390°—переход δ-Fe — γ-Fe;
при t=898° —переход γ-Fe — β-Fe;
при t=775° —переход β-Fe — α-Fe.
При нагревании железа превращения совершаются в обраном порядке, причем переход β -Fe — > γ-Fe происходит при t= 910° В γ-Fe атомы расположены более тесно, чем в β-Fe, поэьтому переход γ-Fe в β-Fe сопровождается увеличением объема, и наоборот, переход β-Fe в γ-Fe сопровождается уменьшена объема. Фора γ-Fe не магнитна.
Форма α-Fe магнитна. Форма β-Fe не магнитна, но имеет такую же кристаллическую решетку, как магнитная форма α-Fe — поэтому в металлографическом отношении форма β-Fe отождествляется с формой α-Fe и обе формы условно объединяю под одним названием α-Fe.
Главную роль в технологических процессах горячей механической и термической обработки железоуглеродистых сплавов играют: α -Fe и γ-Fe.
Рис. 2 Кривая охлаждения железа
Важное значение для термообработки имеет свойство γ -Fe давать с углеродом твердые растворы. Наибольшая растворимость углерода в γ-Fe (до 1,7%) наблюдается при t=1130°. При повышении и понижении температуры от t= 1130° растворимость углерода в γ-Fe понижается.
Твердый раствор углерода и других элементов в γ-Fe называется аустенитом. α-Fe не образует с углеродом устойчивых твердых растворов, подобно аустениту. Растворимость углерода в α -Fe ничтожна. Твердые растворы небольших количеств С и прочих элементов в α-Fe называют ферритом.
Кроме твердых растворов углерода в железе, в железоуглеродистых сплавах встречается химическое соединение железа с углеродом — карбид железа Fe3C, который называется цементитом. Цементит содержит С — 6,67 %. Аустенит и феррит отличаются пластичностью, феррит, кроме того, — мягкостью. Цементит чрезвычайно тверд и хрупок.
Атомно — кристаллическое строение металлов
Внутреннее строение металлов и их характеристики определяют их физико-химические свойства. Электроны на внешних орбитах атомов слабо связаны с ядром и имеют отрицательный заряд. При наличии разницы потенциалов электроны мигрируют к положительному полюсу, создавая электрический ток. Это физическое явление обуславливает электропроводность.
Кристаллическое строение свойственно металлам и их сплавам в твердом фазовом состоянии. Атомы выстраиваются в определенную объемную структуру, называемую кристаллической решеткой. Число атомов в вершинах и на гранях этой структуры, а также дистанция между ними определяют такие физические свойства металла, как электро- и теплопроводность, вязкость, текучесть и т.д. Кристаллическое строение металлов и сплавов может быть двух типов:
- Межатомная дистанция одинакова по всем направлениям. Это так называемое изотропное строение. При этом физические свойства кристалла также одинаковы по всем направлениям.
Межатомное расстояние по горизонтали и по вертикали разное. Такой кристалл называют анизотропным, и его физические параметры меняются в зависимости от направления.
Атомно-кристаллическое строение металлов
В реальном куске металлов, составленному из множества изолированных кристаллических фрагментов, атомно кристаллическое строение принадлежит к третьему типу — квазиизотропному. В среднем свойства такого куска близки к изотропным. При выстраивании кристаллической решетки некоторые атомы не попадают на свое место, смещаются или теряются. В этом случае говорят о дефектах кристаллического строения металлов. Дефекты структуры отрицательно влияют на свойства изделия, особенно если оно должно быть монокристаллом, как, например, в электронике, лазерной технике и других отраслях высоких технологий.
ПРИМЕНЕНИЕ
Кольцо из железа
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства. Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов. Железо может входить в состав сплавов на основе других металлов — например, никелевых. Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п. Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса. Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей. Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат. Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве. Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах. Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
Железо (англ. Iron) — Fe
| Молекулярный вес | 55.85 г/моль |
| Происхождение названия | возможно англо-саксонского происхождения |
| IMA статус | действителен, описан впервые до 1959 (до IMA) |
Атомная кристаллическая решетка
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные ковалентные связи. Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
Железо, свойства атома, химические и физические свойства.
Fe 26 Железо
55,845(2) 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Железо — элемент периодической системы химических элементов Д. И. Менделеева с атомным номером 26. Расположен в 8-й группе (по старой классификации — побочной подгруппе восьмой группы), четвертом периоде периодической системы.
Атом и молекула железа. Формула железа. Строение атома железа
Изотопы и модификации железа
Свойства железа (таблица): температура, плотность, давление и пр.
Физические свойства железа
Химические свойства железа. Взаимодействие железа. Химические реакции с железом
Получение железа
Применение железа
Таблица химических элементов Д.И. Менделеева
Типы кристаллических решеток
Дистанцию соседними атомами называют параметром решетки, у разных металлов он составляет 2 — 6 ангстрем. Существуют три основных типа кристаллических решеток:
- Кубическая: объемно-центрированная — включает в себя девять атомов. Свойственна железу, хрому, молибдену, и ванадию.
- Кубическая гранецентрированная: включает в себя уже 14 атомов. Присуща меди, золоту, свинцу, алюминию.
- Гексагональная: атомов уже 17 и размещены они наиболее плотно. Так кристаллизуются магний, цинк кадмий и другие.
Уникальная возможность железа заключается в том, что до 910°С оно имеет кубическую объемно-центрированную структуру, а при нагреве свыше этой температуры переходит к гранецентрированной.
Дополнительные сведения:
| 513 | Параметры решётки | 2,866 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 460 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 521 | Кристаллическая решётка #2 | γ-железо (аустенит) |
| 522 | Структура решётки | Кубическая гранецентрированная |
| 523 | Параметры решётки | 3,656 Å |
| 524 | Отношение c/a | |
| 525 | Температура Дебая | |
| 526 | Название пространственной группы симметрии | Fm_ 3m |
| 527 | Номер пространственной группы симметрии | 225 |
| 531 | Кристаллическая решётка #3 | δ-железо |
| 532 | Структура решётки | Кубическая объёмно-центрированная |
| 533 | Параметры решётки | 2,93 Å |
| 534 | Отношение c/a | |
| 535 | Температура Дебая | |
| 536 | Название пространственной группы симметрии | Im_ 3m |
| 537 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7439-89-6 |
Металлическая кристаллическая решетка
Тип связи металлической кристаллической решетки гибче и пластичнее ионной, хотя внешне они весьма похожи. Отличительной особенностью ее является наличие положительно заряженных катионов (ионов метала) в узлах решетки. Между узлами живут электроны, участвующие в создании электрического поля, эти электроны еще называются электрическим газом. Наличие такой структуры металлической кристаллической решетки объясняет ее свойства: механическую прочность, тепло и электропроводность, плавкость.
Атомная кристаллическая решётка
В узлах находятся атомы, о чём и говорит название. Эти вещества очень крепкие и прочные, так как между частицами образуется ковалентная связь. Соседние атомы образуют между собой общую пару электронов (а, точнее, их электронные облака наслаиваются друг на друга), и поэтому они очень хорошо связаны друг с другом. Самый наглядные пример – алмаз, который по шкале Мооса обладит наибольшей твёрдостью. Интересно, что алмаз, как и графит, состоит из углевода. Графит является очень хрупким веществом (твёрдость по шкале Мооса – 1), что является наглядным примером того, как много зависит от вида.
Кристаллические решетки, видео
И в завершение подробное видео пояснения о свойствах кристаллических решеток.
Автор: Павел Чайка, главный редактор журнала Познавайка
При написании статьи старался сделать ее максимально интересной, полезной и качественной. Буду благодарен за любую обратную связь и конструктивную критику в виде комментариев к статье. Также Ваше пожелание/вопрос/предложение можете написать на мою почту [email protected] или в Фейсбук, с уважением автор.
Научно-популярный журнал Познавайка
Эта статья доступна на английском – Crystal Lattice in Chemistry.
Металлическая кристаллическая решётка
Из-за наличия в узлах ионов, может показаться, что металлическая решетка похожа на ионную. На самом деле, это две совершенно разные модели, с разными свойствами.
Металлическая гораздо гибче и пластичнее ионной, для неё характерна прочность, высокая электро- и теплопроводность, эти вещества хорошо плавятся и отлично проводят электрический ток. Это объясняется тем, что в узлах находятся положительно заряженные ионы металлов (катионы), которые могут перемещаться по всей структуре, тем самым обеспечивают течение электронов. Частицы хаотично движутся около своего узла (они не имеют достаточной энергии, чтобы выйти за пределы), но как только появляется электрическое поле, электроны образуют поток и устремляются из положительной в отрицательную область.
Металлическая кристаллическая решётка характерна для металлов, например: свинец, натрий, калий, кальций, серебро, железо, цинк, платина и так далее. Помимо прочего, она подразделяется ещё на несколько типов упаковок: гексагональная, объёмно центрированная (наименее плотная) и гранецентрированная. Первая упаковка характерна для цинка, кобальта, магния, вторая для бария, железа, натрия, третья для меди, алюминия и кальция.
Таким образом, от типа решётки зависят многие свойства, а также строение вещества. Зная тип, можно предсказать, к примеру, какой будет тугоплавкость или прочность объекта.
Кристаллическая решетка железа
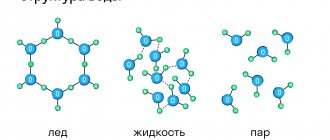
Основными строительными блоками твердых веществ, таких как соль или лед, являются молекулы. Каждая молекула состоит из двух или более атомов, например, натрий+хлор (NaCl), как у поваренной соли и водород+кислород, как у льда (H2O). В металлах, однако, такими строительными блоками являются отдельные атомы металла: атомы железа (Fe) в железном прутке или меди (Cu) в медной проволоке. Каждое зерно на рисунке 1 есть то, что называется кристаллом. В кристалле, который состоит из атомов, все атомы однородно расположены по слоям. Как показано на рисунке 2, если провести линии, которые соединяют центры атомов, то трехмерные ряды маленьких кубиков заполнят все пространство, занимаемое отдельным зерном. Эту трехмерную структуру и называют кристаллической решеткой атомов.
Рисунок 2 – Кристаллическая решетка железа
Свойства атома железа :
200
| Свойства атома | ||
| 201 | Атомная масса (молярная масса) | 55,845(2) а.е.м. (г/моль) |
| 202 | Электронная конфигурация | 1s 2 2s 2 2p 6 3s 2 3p 6 3d 6 4s 2 |
| 203 | Электронная оболочка | K2 L8 M14 N2 O0 P0 Q0 R0 |
152 пм – high-spin
(в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле)
| 400 | Физические свойства | |
| 401 | Плотность | 7,874 г/см 3 (при 0 °C/20 °C и иных стандартных условиях, состояние вещества – твердое тело), |
6,98 г/см 3 (при температуре плавления 1538 °C и иных стандартных условиях, состояние вещества – жидкость),
6,9 г/см 3 (при 1589 °C и иных стандартных условиях, состояние вещества – жидкость)
Кристаллическое строение металлов. Типы кристаллических решеток
Когда металл образует твердую структуру, то все его атомы стремятся занять такие положения в пространстве относительно друг друга, чтобы они соответствовали минимуму потенциальной энергии. Этому минимуму соответствует кристаллическая решетка.
Под кристаллической решеткой понимают такую пространственную атомную структуру, которая может быть получена, если известны координаты ограниченного числа ее атомов и вектора их трансляции в пространстве. Указанное число атомов называется базисом решетки, а их положения образуют так называемую элементарную ячейку.
Все металлы кристаллизуются в трех основных типах решеток:
- гранецентрированная кубическая (ГЦК);
- объемно-центрированная кубическая (ОЦК);
- гексагональная плотноупакованная (ГПУ).
Благодаря кристаллическому строению металлы обладают такими свойствами, как пластичностью, упругостью и металлическим блеском.
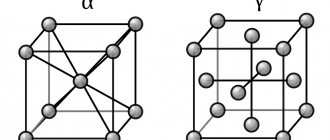
Решетки ГЦК, ОЦК, ГПУ
Изучая кристаллическое строение металлов, охарактеризуем подробнее каждый тип кристаллической решетки. Начнем с ГЦК. Она показана ниже на рисунке.
Как видно, это решетка представляет собой кубик, в котором атомы расположены в его вершинах и в центрах всех шести граней. Применяя методы кристаллографии, несложно показать, что для получения такой решетки в пространстве достаточно всего четырех атомов и векторов трансляций, совпадающих с ребрами куба.
Примерами металлов, которые кристаллизуются в ГЦК, являются алюминий, медь, золото и серебро. Железо образует ГЦК решетку только при высоких температурах.
ОЦК решетка показана ниже.
Мы видим, что она соответствует кубику, в вершинах и в центре которого находится атом. Всего два атома необходимо, чтобы в прямоугольных декартовых координатах построить ОЦК решетку. Такие металлы, как ванадий, тантал, ниобий, вольфрам имеют именно эту кристаллическую структуру.
Наконец, ГПУ решетка. Она представлена ниже на рисунке.
Эта кристаллическая решетка металлов отличается от двух предыдущих тем, что она в пространстве образует не куб, а правильную шестиугольную призму, которая состоит из шести атомов. В данной структуре кристаллизуются такие элементы, как титан, цирконий, магний и кобальт.
Примечание:
115* Температура и иные условия перехода аллотропных модификаций железа друг в друга согласно [1]:
— α-железо (феррит) существует при температуре ниже 770 °C и нормальных условиях (точка Кюри железа согласно [1] 770 °C),
— β-железо существует в интервале температур от 770 °C до 912 °C и нормальных условиях,
— γ-железо (аустенит) существует в интервале температур от 912 °C до 1394 °C и нормальных условиях,
— δ-железо существует при температуре выше 1394 °C и нормальных условиях,
— ε-железо существует при температуре несколько сотен °C и давлении более 10 ГПа либо при более высоком давлении и нормальных условиях.
205* Эмпирический радиус атома железа согласно [1] и [3] составляет 126 пм.
206* Ковалентный радиус железа согласно [1] составляет 132±3 пм (low-spin) и 152±6 пм (high-spin), ковалентный радиус железа согласно [3] [Россия] составляет 117 пм.
402* Температура плавления железа согласно [3] и [4] составляет 1538,85 °C (1812 К, 2801,93 °F) и 1539 °C (1812,15 К, 2802,2 °F) соответственно.
403* Температура кипения железа согласно [4] составляет 2870 °C (3143,15 К, 5198 °F).
407* Удельная теплота плавления (энтальпия плавления ΔHпл) железа согласно [3] и [4] составляет 13,8 кДж/моль.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) железа согласно [4] составляет 350 кДж/моль.
410* Молярная теплоемкость железа согласно [3] составляет 25,14 Дж/(K·моль).
428* Точка Кюри железа согласно [1] составляет 770 °C (1043 K, 1418 °F).
Источник
Кристаллическое строение
МАТЕРИАЛОВЕДЕНИЕ
Вещества могут находиться в трех агрегатных состояниях: твердом, жидком и газообразном. Переход из твёрдого состояния в газообразное называется сублимацией.
Все металлы являются телами кристаллическими.
Для каждого металла характерна своя пространственно- кристаллическая решетка с дальним порядком расположения атомов (определенное расположение атомов на любом расстоянии).
В твердых телах порядок расположения атомов закономерен. Расположение атомов можно представить в виде элементарных кристаллических ячеек. Всего существует 14 типов решеток: для металлов характерны 3 типа:
1. Объемно — центрированная кубическая (ОЦК);
2. Гране — центрированная кубическая (ГЦК);
3. Гексагональная плотно упакованная (ГПУ).
Железо имеет два варианта кристаллических решеток:
— объемно-центрированную кубическую: атомы располагаются в центре куба и по его вершинам;
— гранецентрированную кубическую: атомы располагаются в центрах граней и по вершинам куба.
Ряд металлов изменяет тип кристаллической решетки при изменении температуры, такое свойство металлов называется полиморфизмом (многоформие, аллотропия). Для железа (Fe) при температуре до 911 °C — ОЦК; от 911 до 1392 °C — ГЦК; свыше 1392 °C — ОЦК.
Металлы состоят из большого числа кристаллов неправильной формы, которые называются зернами. В реальных металлах кристаллическая решетка не является идеальной. Внутренняя структура зерна имеет дефекты.
Дефекты кристаллической решетки:
1. Точечные (нульмерные);
2. Линейные (одномерные);
3. Поверхностные (двухмерные);
4. Объемные (трехмерные).
Незанятые атомами места называются «вакансией». Атомы других элементов могут замещать атомы или внедрятся в решетку. Монолитность сварных соединений обеспечивается появлением атомно-молекулярных связей между элементарными частицами соединяемых веществ: ковалентной, ионной, межмолекулярной, металлической. Для соединения материалов необходимо обеспечить контакт по стыкуемой поверхности и активизировать ее. Энергия активации соединяемым поверхностям передается в виде теплоты, упругопластической деформации, электронного или иного вида облучения. Энергия необходима для обрыва связей между атомами вещества и внешней средой, а также для перехода их в активное состояние.
Металлическая связь (решетка) характеризуется достаточной прочностью и пластичностью и зависит от типа и количества элементов решетки.
К объемным дефектам относятся трещины, непровары, несплавления, поры, шлаки (имеют значительные размеры в 3-х измерениях).
Упрощённая классификацияжелезоуглеродистых сплавов
Условно считается, что железоуглеродистые сплавы, содержащие менее 2,14% углерода – стали, более 2,14% — чугуны. К сплавам относят соединения, содержащие менее 50% железа.
Углеродистые стали в своем составе имеют железо и углерод. Для придания особых свойств в сталь вводят другие элементы. Такие стали называются легированными.
Углеродистые стали общего назначения поставляются:
группа А – с гарантируемыми механическими свойствами (сталь не подвергается термообработке);
группа Б — с гарантируемым химическим составом (сталь подвергается термообработке);
группа В — с гарантируемыми механическими свойствами и химическим составом.
Кипящие стали (кп) раскисляются Mn, полуспокойные (пс) – Mn, Si, спокойные (сп) – Mn, Si, Al.
Пример обозначения стали группы А – Ст.3кп, группы В –В Ст.3сп.
Качественные углеродистые стали отличаются пониженным содержанием вредных примесей – фосфора и серы. В обозначении сталей цифры означают содержание углерода в сотых долях процента, например – Сталь 10 содержит 0,10 % углерода.
Малоуглеродистые стали содержат углерода менее 0,25 %, среднеуглеродистые – 0,25…0,46 %, высокоуглеродистые – более 0,46 %.
Легирование позволяет повысить прочностные свойства, обеспечивает коррозионную стойкость, жаропрочность и т.п. В зависимости от содержания легирующих элементов стали разделяются на низколегированные (до 2,5 %), среднелегированные (2,5…10 %) и высоколегированные ( более 10 %).
ЗАПАСЫ И ДОБЫЧА
Железо — один из самых распространённых элементов в Солнечной системе, особенно на планетах земной группы, в частности, на Земле. Значительная часть железа планет земной группы находится в ядрах планет, где его содержание, по оценкам, около 90 %. Содержание железа в земной коре составляет 5 %, а в мантии около 12 %.
Железо
В земной коре железо распространено достаточно широко — на его долю приходится около 4,1 % массы земной коры (4-е место среди всех элементов, 2-е среди металлов). В мантии и земной коре железо сосредоточено главным образом в силикатах, при этом его содержание значительно в основных и ультраосновных породах, и мало — в кислых и средних породах. Известно большое число руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк (гематит, Fe2O3; содержит до 70 % Fe), магнитный железняк (магнетит, FeFe2O4, Fe3O4; содержит 72,4 % Fe), бурый железняк или лимонит (гётит и гидрогётит, соответственно FeOOH и FeOOH·nH2O). Гётит и гидрогётит чаще всего встречаются в корах выветривания, образуя так называемые «железные шляпы», мощность которых достигает несколько сотен метров. Также они могут иметь осадочное происхождение, выпадая из коллоидных растворов в озёрах или прибрежных зонах морей. При этом образуются оолитовые, или бобовые, железные руды. В них часто встречается вивианит Fe3(PO4)2·8H2O, образующий чёрные удлинённые кристаллы и радиально-лучистые агрегаты. Содержание железа в морской воде — 1·10−5-1·10−8 % В промышленности железо получают из железной руды, в основном из гематита (Fe2O3) и магнетита (FeO·Fe2O3). Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс. Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата или окатышей и флюс (например, известняк) подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха. Кроме доменного процесса, распространён процесс прямого получения железа. В этом случае предварительно измельчённую руду смешивают с особой глиной, формируя окатыши. Окатыши обжигают, и обрабатывают в шахтной печи горячими продуктами конверсии метана, которые содержат водород. Водород легко восстанавливает железо, при этом не происходит загрязнения железа такими примесями, как сера и фосфор, которые являются обычными примесями в каменном угле. Железо получается в твёрдом виде, и в дальнейшем переплавляется в электрических печах. Химически чистое железо получается электролизом растворов его солей.
Общее строение
Металлы – твёрдые вещества, имеющие кристаллическое строение. Исключение составляет ртуть – жидкий металл. Кристаллические решётки представляют собой упорядоченные определённым образом атомы металла. Каждый атом состоит из положительно заряженного ядра и нескольких отрицательно заряженных электронов. В атомах металлов недостаточно электронов, поэтому они являются ионами.
Единица кристаллической решётки – элементарная кристаллическая ячейка, в условных узлах и на гранях которой находятся положительно заряженные ионы. Их удерживают вместе металлические связи, возникающие за счёт беспорядочного движения отделившихся от атомов электронов (благодаря чему атомы превратились в ионы).
Рис. 1. Схема металлической связи.
Свободное движение электронов обусловливает электро- и теплопроводность металлов.
БЫСТРО
SEO оптимизация
адаптивная верстка
Ремонт в регионах
- Главная
- Строительные материалы
- Кристаллическое строение металлов
- Альфа-бета-сигма-гамма железо
Ярким примером аллотропии является железо, образующее в зависимости от температуры четыре основных аллотропических видоизменения, которые называют: α-Fе, β-Fe, γ-Fe, δ-Fe.
Аллотропические формы α-Fe — альфа железо, β-Fe — бета железо и δ-Fe — сигма железо имеют кристаллическую решетку в форме центрированного куба ( рис. 1, а). Аллотропическая форма γ-Fe — гамма железо имеет кристаллическую решетку в форме куба с центрированными гранями (рис. 1, б).
Переход железа из одной формы в другую — при охлаждении происходит с выделением тепла, а при нагревании — с поглощением тепла. Это отмечается на графиках охлаждения или нагревания железа На рис. 2 дан схематический график охлаждения чистого железа.
Физические свойства железа:
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга* | — α-железо (феррит) существует при температуре ниже 769 °C и нормальных условиях (точка Кюри железа 769 °C), — β-железо существует в интервале температур от 769 °C до 917 °C и нормальных условиях, — γ-железо (аустенит) существует в интервале температур от 917 °C до 1394 °C и нормальных условиях, — δ-железо существует при температуре выше 1394 °C и нормальных условиях, |
Что такое перлит и эвтектоид
Наблюдения показывают, что этот переход происходит следующим образом: по достижении температур GS по границам Наблюдения показывают, что этот переход происходит следующим образом : по достижении температур GS по границам аустенитовых кристаллов выделяются первые порции α — Fe, т. е. феррита, количество которого постепенно увеличивается.
Так как феррит почти не растворяет углерода, то при переходе γ-Fe -> α-Fe концентрация углерода в остаточном аустените постепенно увеличивается и может быть определена по линии G S в зависимости от температуры. Процесс выделения феррита протекает так до тех пор, пока концентрация углерода не будет соответствовать точке 5, т. е. до С=0,83%, а температура не достигнет t=723°.
В точке S кривая GS пересекается с ES — кривой предельной растворимости углерода в аустените. Поэтому дальнейшее насыщение остаточного аустенита углеродом становится уже невозможным, и последующее охлаждение вызывает окончательный распад аустенита, который совершается при постоянной температуре t=723°.
При этом распаде завершается переход γ- Fe->α-Fe, а выделившийся из кристаллической решетки железа углерод образует частицы цементита F3C. Распад аустенита происходит в стесненном объеме в пределах каждого зерна, поэтому продукты распада (феррит и цементит) образуются в виде тесно перемешанных частиц, обычно в виде чередующихся пластинок феррита и цементита.
Схема изменений структуры сталей при переходе через критические точки
Этот продукт распада аустенита называется перлитом; так как перлит имеет строение, подобное эвтектике, то он называется эвтектоидом. Разница между эвтектикой и эвтектоидом заключается в том, что эвтектика образуется из жидкого раствора, а эвтектоид — из твердого.
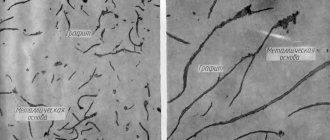
Образование перлита начинается и заканчивается при постоянной t=723°. Так ппявляется феррито-перлитовая структура сталей, которая при дальнейшем охлаждении от t=723° не претерпевает больше никаких структурных изменений. На рисунке представлены микроструктуры чистого железа и стали при С =0,15% и при С=0,6% (увеличение 100) после травления по-шрованной поверхности микрошлифа 4% раствором HNO3 в этиловом спирте.
Рис. 1. — феррит в чистом железе. Рис. 2 Доэвтектоидная сталь с содержанием С=0,15%
На рис. 1, где показана микроструктура чистого железа, четко выявились границы между светлыми зернами феррита. На рис. 2 представлена микроструктура строительной стали (С=0,15%); светлые поля — это феррит, темные участки — перлит. На рис. 3 приведена микроструктура машиностроительной стали (С=0,6%), из которой изготовляют оси, валы, шатуны и т. п.; большая часть шлифа занята перлитом, а феррит наблюдается только в виде тонкой сетки. Чем больше углерода, тем больше в структуре стали перлита, состав перлита одинаков (С=0,83%). Строение перлита обычно пластинчатое (рис. 4).
Рис. 3 Доэвтектоидная сталь с содержанием С=0,6%. Рис. 4 Эвтектоидная сталь (пластинчатый перлит).
Феррит, как было указано выше, представляет собой наиболее мягкую пластичную составляющую железоуглеродистых сплавов; цементит, входящий в состав перлита, наиболее твердую и хрупкую, поэтому с увеличением содержания углерода увеличивается прочность и твердость стали, но пластичность и вязкость уменьшаются
Чтобы строительная сталь была достаточно пластичной, количество перлита в ней не должно превосходить 25%, что соответствует содержанию углерода до 0,2%.
В. тех деталях, от которых требуется большая прочность и твердость, но допустимы меньшая пластичность и вязкость (детали машин), применяются стали с большим количеством перлита, с содержанием С до 0,6%. В строительном деле такие стали применяются, например, для изготовления лопат, опорных частей мостовых ферм.
ПРОИСХОЖДЕНИЕ
Происхождение теллурическое (земное) железо редко встречается в базальтовых лавах (Уифак, о. Диско, у западного берега Гренландии, вблизи г. Касселя Германия). В обоих пунктах с ним ассоциируют пирротин (Fe1-xS) и когенит (Fe3C), что объясняют как восстановление углеродом (в том числе и из вмещающих пород), так и распадом карбонильных комплексов типа Fe(CO)n. В микроскопических зернах оно не раз устанавливалось в измененных (серпентинизированных) ультраосновных породах также в парагенезисе с пирротином, иногда с магнетитом, за счет которых оно и возникает при восстановительных реакциях. Очень редко встречается в зоне окисления рудных месторождений, при образовании болотных руд. Зарегистрированы находки в осадочных породах, связываемые с восстановлением соединений железа водородом и углеводородами.
Почти чистое железо найдено в лунном грунте, что связывают как с падениями метеоритов, так и с магматическими процессами. Наконец, два класса метеоритов — железокаменные и железные содержат природные сплавы железа в качестве породообразующего компонента.