Содержание
- 1 Исторические сведения
- 2 Происхождение названия
- 3 Нахождение в природе
- 4 Получение 4.1 Производство в мире
- 7.1 Галогениды свинца
- 8.1 Распространённость изотопов свинца
- 9.1 В медицине
Слитки свинца
Экологические характеристики
Загрязнение свинцом окружающей среды считается одним из самых опасных. Все изделия, где используется свинец, нуждаются в специальной утилизации, которая проводится только лицензированными службами.
К сожалению, загрязнение свинцом обеспечивается не только деятельностью предприятий, где это хоть худо-бедно, да регулируется. В городском воздухе наличие свинцовых паров обеспечивает сгорание топлива в автомобилях. На этом фоне наличие свинцовых стабилизаторов в таких, например, привычных конструкциях, как металлопластиковое окно уже не кажется стоящим внимания.
Свинец – металл, имеющий промышленное значение. Несмотря на токсичность, в народном хозяйстве он используется слишком широко, чтобы можно было металл чем-то заменить.
О свойствах солей свинца поведает данное видео:
Исторические сведения
Свинец используется многие тысячелетия, поскольку он широко распространён, легко добывается и обрабатывается. Он очень ковкий и легко плавится. Выплавка свинца была первым из известных человеку металлургических процессов. Бусины из свинца, датируемые 6400 г. до н. э., были найдены в культуре Чатал-Хююк. Самым древним предметом, сделанным из свинца, часто считается статуэтка стоящей женщины в длинной юбке времён первой династии Египта, датируемая 3100—2900 гг. до н. э., хранящаяся в Британском музее (инвентарный номер EA 32138). Она была найдена в храме Осириса в Абидосе и привезена из Египта в 1899 году. В Древнем Египте использовались медальоны из свинца. В раннем бронзовом веке свинец использовался наряду с сурьмой и мышьяком. Указание на свинец как на определённый металл имеется в Ветхом Завете.
Свинцовые трубы древнеримского водопровода с надписями
Самым крупным производителем свинца доиндустриальной эпохи был Древний Рим, с годовым производством 80 000 тонн. Добыча римлянами свинца происходила в Центральной Европе, римской Британии, на Балканах, в Греции, Малой Азии и Испании. Римляне широко применяли свинец в производстве труб для водопроводов, свинцовые трубы часто имели надписи римских императоров. Правда, ещё Плиний и Витрувий считали, что это нехорошо для общественного здоровья.
Папская булла 1637 года со свинцовой печатью
После падения Римской империи в V в. н. э. использование свинца в Европе упало и оставалось на низком уровне около 600 лет. Затем свинец начали добывать в восточной Германии. Свинцовый сахар ещё с римских времён добавляли в вино для улучшения его вкусовых качеств, это стало широко распространено и продолжалось даже после запрета папской буллой в 1498 году. Такое использование свинца в средние века приводило к эпидемиям свинцовой колики. В Древней Руси свинец использовали для покрытия крыш церквей, а также широко применяли в качестве материала навесных печатей к грамотам Позднее, в 1633 году, в Кремле был сооружён водопровод со свинцовыми трубами, вода по которому шла из Водовзводной башни, он просуществовал до 1737 года.
В алхимии свинец ассоциировался с планетой Сатурн и обозначался её символом ♄. В древности олово, свинец и сурьму часто не отличали друг от друга, считая их разными видами одного и того же металла, хотя ещё Плиний Старший различал олово и свинец, называя олово «plumbum album», а свинец — «plumbum nigrum».
Индустриальная революция привела к новому росту потребности в свинце. К началу 1840-х гг. годовое производство очищенного свинца впервые превысило 100 000 тонн и выросло до более чем 250 000 тонн в течение следующих 20 лет. До последних десятилетий XIX века добыча свинца в основном проводилась тремя странами: Британией, Германией и Испанией. К началу XX века добыча свинца в Европе стала меньше, чем в остальном мире, благодаря увеличившейся добыче в США, Канаде, Мексике и Австралии. До 1990 года большое количество свинца использовалось (вместе с сурьмой и оловом) для отливки типографских шрифтов, а также в виде тетраэтилсвинца — для повышения октанового числа моторного топлива.
От атомной энергетики до рыбацких утех
В промышленности и быту обширно применение свинца.
Сферы применение свинца
В медицине без укрытий из металла не обойтись в рентгенологических исследованиях.
В геологии «тяжёлый» металл используется для определения возраста Земли и в частности ее минералов и горных пород. Это геохронологические методы с помощью изотопов различных элементов, в том числе свинца.
Рекомендуем: ЦЕЗИЙ — металл со взрывным характером
Исчезни завтра все свинцово-кислотные аккумуляторы, нам пришлось бы пересаживаться на лошадей, велосипеды или пойти пешком. Свинец движет все автомобили на планете.
Он же, наш серый герой, входит в составы для пайки. И попробуйте доказать рыбаку, что без грузила из свинца он как-нибудь обойдется.
Как металл стал орудием убийства
Создается впечатление, что человечество не может без войн, драк, разборок или хотя бы охоты. Увлечение сильной половины человечества всегда означало близкий контакт со свинцом. Свинец прост в обработке. Еще в Древнем Риме снаряды для пращей отливали из свинца. Позже из него столетиями изготавливали пули. По сей день пули делают из свинца по одной простой причине — большой пробивной способности относительно размера и скорости полета пули.
В первых огнестрельных орудиях убийства пули были просто свинцовыми шариками, сейчас это прекрасно сбалансированные, имеющие разные конструкции, маленькие убийцы. Но будь это обычная или специальная (бронебойная, экспансивная, разрывная), пуля содержит свинец. Сердечники пули делают из свинцовой проволоки (для 45 калибра проволока потолще, для 20 калибра пойдет тонкая). Сердечники «одевают» в гильзы из меди.
Нитраты, перхлораты и азиды свинца применяют в приготовлении взрывчатых веществ.
Мрачное прошлое металла
Об ядовитых свойствах металла писали Плиний и врач Диоскорид (их беспокоили свинцовые трубы водопровода и плитки из металла, которыми выкладывали стены и иногда пол).
Русский царь Алексей Михайлович, проводя реконструкцию Кремля, приказал установить на Водовзводной башне машину, которая поднимала воду в Кремль. Все хорошо, только вот трубы были свинцовые. Часть историков и медиков винят воздействие металла на потомство царя. Его дети, Федор и Иван были очень больными. На Петре Великом питье свинцовой воды тоже отразилось. В кино царь-батюшка красавец, а в жизни был нескладным, узкие плечи, широкий таз, длинные руки и ноги.
Отравление соединениями токсичного металла продолжались и дальше.
ТЭС (тетраэтилсвинец)
Наша любовь к четырехколесным и скорости привела к разработке этого вещества. Точнее, к его добавлению в бензин, который стали звать «этилированным». На таком бензине машинки бегали быстрее, и становилось их все больше. Дело шло к геохимической катастрофе — ТЭС был в земле, в воздухе, в человеческих организмах. Правительства стран спохватились — такими темпами, со свинцовыми отравлениями править скоро станет некем. И ввели запрет на этилированные бензины.
Похожие публикации
- ПЛАТИНА — «гнилое серебро» или благородный металл
- БРОНЗА — сплав для всех времен и народов
- ВИСМУТ — радиоактивный и безопасный
- ТАНТАЛ — твёрдый, редкий и дорогой
Происхождение названия
Происхождение слова «свинец» неясно. Этот металл по-болгарски называется «оло́во», в большинстве других славянских языков (сербско-хорватском, чешском, польском свинец называется словом, близким по звучанию к «олово»: волава
,
olovo
,
ołów
и т. п. Слово с тем же значением, но похожее по произношению на «свинец», встречается в языках балтийской группы:
švinas
(литовский),
svins
(латышский), а также в нескольких славянских — русском, украинском (
свинець
), белорусском (
свінец
) и словенском (
svinec
).
Латинское plumbum
дало английское слово
plumber
— водопроводчик (в Древнем Риме трубы водопровода были именно из этого металла, как наиболее подходящего для отливки), и название венецианской тюрьмы со свинцовой крышей — Пьомби, из которой, по некоторым данным, ухитрился бежать Казанова.
Нахождение в природе
Содержание в земной коре — 1,6·10−3 % по массе. Самородный свинец встречается редко, круг пород, в которых он установлен, достаточно широк: от осадочных пород до ультраосновных интрузивных пород. В этих образованиях он часто образует интерметаллические соединения (например, звягинцевит (Pd,Pt)3(Pb,Sn) и др.) и сплавы с другими элементами (например, (Pb + Sn + Sb)). Он входит в состав 80 различных минералов. Важнейшие из них: галенит PbS, церуссит PbCO3, англезит PbSO4 (сульфат свинца); из более сложных — тиллит PbSnS2 и бетехтинит Pb2(Cu,Fe)21S15, а также сульфосоли свинца — джемсонит FePb4Sn6S14, буланжерит Pb5Sb4S11. Всегда содержится в рудах урана и тория, имея часто радиогенную природу. В природных условиях часто образует крупные залежи свинцово-цинковых или полиметаллических руд стратиформного типа (Холоднинское, Забайкалье), а также скарнового (Дальнегорское (бывшее Тетюхинское), Приморье; Брокен-Хилл в Австралии) типа; галенит часто встречается и в месторождениях других металлов: колчеданно-полиметаллических (Южный и Средний Урал), медно-никелевых (Норильск), урановых (Казахстан), золоторудных и др. Сульфосоли обычно встречаются в низкотемпературных гидротермальных месторождениях с сурьмой, мышьяком, а также в золоторудных месторождениях (Дарасун, Забайкалье). Минералы свинца сульфидного типа имеют гидротермальный генезис, минералы окисного типа часты в корах выветривания (зонах окисления) свинцово-цинковых месторождений. В кларковых концентрациях свинец входит практически во все породы. Единственное место на земле, где в породах больше свинца по сравнению с ураном — Кохистанско-Ладакхская дуга на севере Пакистана.
Галенит, Дальнегорское скарновое месторождение
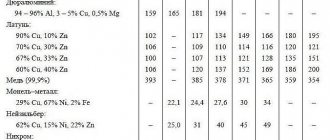
В таблице приведены некоторые параметры распространённости свинца в природных условиях по А. П. Виноградову:
| Породы | Каменные метеориты | Дуниты и др. | Базальты и др. | Диориты и др. | Граниты и др. | Глины и др. | Земная кора |
| Содержание, масс.% | 0000002×10−5 | 0001×10−5 | 0008×10−4 | 0001,5×10−3 | 0002×10−3 | 0002×10−3 | 1,6×10−3 |
| Объекты | Живое вещество Земли | Литосфера | Почва0 | Растения (в золе) | Вода океанов (мг/л) |
| Содержание, масс.% | 000000005×10−5 | 000,0016 | 00,001 | 000000,001 | 0000000,00003 |
Обобщённые концентрации элементов в минералах приведены в таблице, в скобках — количества минералов, по которым рассчитаны средние содержания компонентов.
| Минерал | Свинец (общ) | Уран | Торий |
| 00Настуран | 04,750 (308) | 58,87 (242) | 2,264 (108) |
| 00Монацит | 00,6134 (143) | 0,2619 (160) | 6,567 (150) |
| 000Ортит | 00,0907 (90) | 0,1154 (88) | 6,197 (88) |
| 000Циркон | 00,0293 (203) | 0,1012 (290) | 0,1471 (194) |
| Сфен (Титанит) | 00,0158 (12) | 0,0511 (14) | 0,0295 (21) |
Получение
Для получения свинца в основном используют руды, содержащие галенит. Сначала методом флотации получают концентрат, содержащий 40—70 процентов свинца. Затем возможно несколько способов переработки концентрата в веркблей (черновой свинец): прежде широко распространённый метод шахтной восстановительной плавки, разработанные в СССР метод кислородно-взвешенной циклонной электротермической плавки свинцово-цинковых продуктов (КИВЦЭТ-ЦС), метод плавки Ванюкова (плавка в жидкой ванне). Для плавки в шахтной (ватержакетной) печи предварительно производят агломерационный обжиг концентрата, а затем его загружают в шахтную печь, где происходит восстановление свинца из оксида.
Веркблей, содержащий более 90 процентов свинца, подвергается дальнейшему очищению. Сначала для удаления меди применяют зейгерование и последующую обработку серой. Затем щелочным рафинированием удаляют мышьяк и сурьму. Далее выделяют серебро и золото с помощью цинковой пены и отгоняют цинк. Обработкой кальцием и магнием удаляют висмут. В результате содержание примесей падает до менее чем 0,2 %.
Производство в мире
Страны — крупнейшие производители свинца (включая вторичный свинец) на 2004 год (по данным ILZSG):
| Страна | Количество в метрических килотоннах |
| Евросоюз | 2200 |
| США | 1400 |
| Китай | 1200 |
| Россия | 1100 |
| Южная Корея | 600 |
| Казахстан | 550 |
| Украина | 400 |
Добыча и производство
По оценке Геологического бюро США запасы металла в мире достигают полутора миллиардов тонн. Основной их частью владеют страны:
- Китай;
- США;
- Россия;
- ЮАР;
- Перу;
- Канада;
- Мексика.
Годовое производство металла в мире составляет около 3 миллионов тонн. Дефицит свинца на этом рынке создает Китай. Его спрос на металл составляет около 45% мировой добычи.
Получение нашего серого героя происходит из минералов и из вторичного сырья (тонны аккумуляторов с отработавших срок машин).
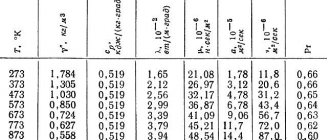
Физические свойства
Свинец имеет довольно низкую теплопроводность, она составляет 35,1 Вт/(м·К), при температуре 0 °C. Металл мягкий, режется ножом, легко царапается ногтем. На поверхности он обычно покрыт более или менее толстой плёнкой оксидов, при разрезании открывается блестящая поверхность, которая на воздухе со временем тускнеет. Температура плавления — 600,61 K (327,46 °C), кипит при 2022 K (1749 °C). Относится к группе тяжёлых металлов; его плотность — 11,3415 г/см3 (при +20 °C). С повышением температуры плотность свинца падает:
Изменение плотности свинца в зависимости от температуры
| Температура, °C | Плотность, г/см3 |
| 327,6 | 10,686 |
| 450 | 10,536 |
| 650 | 10,302 |
| 850 | 10,078 |
Предел прочности на растяжение — 12—13 МПа (МН/м2).
При температуре 7,26 К становится сверхпроводником.
Химические свойства
Электронная формула: 5s25p65d106s26p2, энергия ионизации (Pb → Pb+ + e−) равна 7,42 эВ. На внешней электронной оболочке находятся 4 неспаренных электрона (2 на p- и 2 на d-подуровнях), поэтому основные степени окисления атома свинца — +2 и +4.
- Соли двухвалентного свинца реагируют со щелочами, образуя почти нерастворимый гидроксид свинца:
Pb2+ + 2OH− = Pb(OH)2
- При избытке щёлочи гидроксид растворяется:
Pb(OH)2 + 2OH− = [Pb(OH)4]2−
- Реагирует со щелочами и кислотами:
Pb + 2NaOH + 2H2O = Na2[Pb(OH)4] + H2↑ Pb + 4HNO3 = Pb(NO3)2 + 2NO2↑ + 2H2O Pb + 2HCl = PbCl2 + H2↑
Свинец образует комплексные соединения с координационным числом 4, например, [Pb(OH)4]2−
Реакция диспропорционирования между PbO2 и Pb лежит в основе работы свинцовых аккумуляторов.
Свинцовые баббиты
Это сплавы свинца с целью придать ему лучшую износостойкость и снизить коэффициент трения. В качестве легирующих добавок может быть использован целый ряд металлов – медь, никель, кальций и другие. Баббиты на основе свинца хорошо зарекомендовали себя при производстве подшипников различного назначения:
- вагоны и электровозы;
- крутящиеся части дизелей;
- тяжелая промышленность;
- сложная техника и автомобилестроение.
С 1847 года свинцовые баббиты — неотъемлемая часть российской промышленности. Из недостатков отмечают довольно быстрое разрушение от тяжелых нагрузок, поэтому долговечность агрегатов с применением подобных сплавов сильно зависит от качества металла корпуса подшипникового устройства. Чем он толще и прочнее — тем более объемным можно сделать баббитовый слой, а значит и увеличить срок службы изделия.
Основные соединения свинца
Основная статья: Категория:Соединения свинца
Свинец в соединениях может находиться в степенях окисления +2 и +4, образуя соединения Pb(II) и Pb(IV), соответственно. В обеих степенях окисления свинец является амфотерным и может как выступать в роли катионов Pb2+ и Pb4+, так и входить в состав анионов (плюмбита PbO2- 2 с Pb(II) и плюмбатов с Pb(IV): метаплюмбата PbO2- 3 и ортоплюмбата PbO4- 4), в связи с этим может образовывать четыре типа солей.
Галогениды свинца
Свинец образует галогениды в степени окисления +2 вида PbHal2 для всех галогенов. Известны также галогениды свинца(IV): PbF4 и PbCl4, тетрабромиды и тетрайодиды не получены.
- Фторид свинца(II)
- Хлорид свинца(II) — белый кристаллический порошок, растворим в горячей воде. Хорошо растворяется также в растворах других хлоридов, особенно в хлориде аммония NH4Cl.
- Бромид свинца(II)
- Йодид свинца(II)
Халькогениды свинца
Халькогениды свинца — сульфид свинца PbS, селенид свинца(II) PbSe и теллурид свинца PbTe — представляют собой кристаллы чёрного цвета, которые являются узкозонными полупроводниками.
Оксиды свинца
Основная статья: Оксиды свинца
Оксиды свинца имеют преимущественно основный или амфотерный характер. Многие из них окрашены в красные, жёлтые, чёрные, коричневые цвета. На фотографии в начале статьи, на поверхности свинцовой отливки, в её центре видны цвета побежалости — это тонкая плёнка оксидов свинца, образовавшаяся из-за окисления горячего металла на воздухе. Свинец образует два простых оксида — оксид свинца(II) PbO и оксид свинца(IV) PbO2 — и один смешанный Pb3O4 (свинцовый сурик), фактически являющийся плюмбатом (IV) свинца(II) Pb2PbO4.
Соли свинца
- Сульфат свинца(II) PbSO4
- Нитрат свинца(II) Pb(NO3)2
- Ацетат свинца(II) Pb(CH3COO)2 (свинцовый сахар
). - Хромат свинца(II) PbCrO4
Плюмбаты
Ортоплюмбат кальция — кристаллическое вещество слабо-оранжевого цвета. На протяжении всего 20-го столетия использовался в химии и медицине как источник для простого получения чистого кислорода, который выделяется при нагревании. Способствовала этому и простота синтеза самого вещества — оно получается при прокаливании оксида свинца и карбоната кальция. Дальнейшему успеху мешала лишь токсичность процесса.
Следующая группа плюмбатов применяется в химическом получении сложных свинцовых соединений:
- метаплюмбат натрия;
- гексахлороплюмбат аммония;
- гексахлорсвинцовая кислота;
- триодоплюмбат калия.
Все они легко разлагаются, растворяются в воде и вступают в реакцию с другими соединениями. Это делает их незаменимым сырьем и катализатором для многих процессов, а также базовым компонентом при получении некоторых сложных веществ.
Изотопы
Основная статья: Изотопы свинца
Весь свинец в основном является смесью изотопов 204Pb, 206Pb, 207Pb, 208Pb. Эти изотопы не радиоактивны, то есть стабильны. Свинец — последний элемент в периодической таблице, у которого существуют стабильные изотопы, элементы после свинца стабильных изотопов не имеют (хотя висмут-209 на практике можно считать стабильным, т.к. его период полураспада примерно в миллиард раз больше возраста Вселенной). Изотопы 206Pb, 207Pb, 208Pb являются радиогенными и образуются в результате радиоактивного распада соответственно 238U, 235U и 232Th. Изотоп 208 82Pb126 является одним из пяти существующих в природе дважды магических ядер. Схемы радиоактивного распада имеют вид:
238U → 206Pb + 84He; 235U → 207Pb + 74He; 232Th → 208Pb + 64He.
Уравнения распада имеют вид соответственно:
206Pb =238 U (eλ8t − 1 ), 207Pb =235 U (eλ5t − 1 ), 208Pb =232 Th(eλ2t − 1 ),
где 238U, 235U, 232Th — современные концентрации изотопов; λ8 = 1,55125 ⋅ 10−10 год−1, λ5 = 9,8485 ⋅ 10−10 год−1, λ2 = 4,9475 ⋅ 10−11 год−1 — постоянные распада атомов соответственно урана 238U, урана 235U и тория 232Th.
Кроме этих изотопов, известны и нестабильные изотопы 194Pb — 203Pb, 205Pb, 209Pb — 214Pb. Из них наиболее долгоживущие — 202Pb и 205Pb (с периодами полураспада 52,5 тысяч и 15,3 млн лет). Короткоживущие изотопы свинца 210Pb (радий D), 211Pb (актиний B), 212Pb (торий B) и 214Pb (радий B) имеют периоды полураспада соответственно 22,2 года, 36,1 мин, 10,64 ч и 26,8 мин (в скобках приведены редко используемые исторические названия этих изотопов); эти четыре радиоактивных изотопа входят в состав радиоактивных рядов урана и тория и, следовательно, также встречаются в природе, хотя и в крайне малых количествах.
Количество ядер изотопа 204Pb (нерадиогенного и нерадиоактивного) является стабильным, в минералах свинца концентрация 204Pb во многом зависит от концентрации радиогенных изотопов, образованных как в процессе распада радиоактивных ядер, так и в процессах вторичного преобразования свинецсодержащих минералов. Поскольку число радиогенных ядер, образовавшихся в результате радиоактивного распада, зависит от времени, то и абсолютные, и относительные концентрации зависят от времени образования минерала. Этим свойством пользуются при определении возраста горных пород и минералов.